Các nguyên tắc về bảo vệ bức xạ hiện nay cho rằng việc tiếp xúc với bức xạ dù ở liều thấp hay có tỷ lệ liều thấp dẫn đến các rủi ro sức khỏe đều có liên quan tuyến tính đến liều lượng. Hệ quả được đánh giá bằng cách kết hợp dữ liệu dịch tễ học và các mô hình sinh học phóng xạ. Nghiên cứu được tiến hành với mục đích xem xét việc bức xạ gây ra các tác động có hại thông qua đột biến gen do tổn thương DNA với sự phụ thuộc tuyến tính vào liều lượng. Việc quan sát các tác động biểu sinh do bức xạ gây ra (những thay đổi trong biểu hiện gen mà không làm thay đổi trình tự DNA) và các phản ứng phi tuyến tính, chẳng hạn như các phản ứng không nhắm mục tiêu và thích ứng, mà đến lượt nó có thể được kiểm soát bởi các mạng biểu hiện gen. Các nhà khoa học hiện đang cố gắng xem xét các khía cạnh quan trọng của phản ứng sinh học đối với bức xạ ion hóa trong đó các cơ chế biểu sinh có hoặc có thể có liên quan, tập trung vào các hàm ý có thể có đối với vấn đề liều thấp trong bảo vệ bức xạ. Đặc biệt xem xét ung thư do bức xạ gây ra, các bệnh không phải ung thư và các tác động xuyên thế hệ (di truyền).
Ngày càng có nhiều sự quan tâm trong việc đánh giá tính hiệu quả của các hệ thống bảo vệ bức xạ hiện nay ở liều thấp và/hoặc tỷ lệ liều thấp, điển hình của những lần tiếp xúc tại nơi làm việc, trong môi trường và trong y học chẩn đoán (chiếu xạ các mô bình thường trong xạ trị cũng có thể nằm trong loại tiếp xúc này). Đánh giá định lượng về rủi ro sức khỏe ở các mức độ tiếp xúc này hiện đang được thực hiện bằng cách kết hợp dữ liệu và mô hình dịch tễ học và sinh học phóng xạ. Mặc dù chưa có mô hình toàn diện và “phổ quát” nào về tác động của bức xạ lên các hệ thống sống, tức là mô hình có khả năng mô tả mọi khía cạnh ở các quy mô khác nhau liên quan (phân tử, tế bào, mô, cơ quan, sinh vật), tuy nhiên, nghiên cứu về sinh học phóng xạ, sau hơn một thế kỷ tồn tại, đã cung cấp rất nhiều thông tin về phản ứng sinh học đối với bức xạ ion hóa. Một số khái niệm chung quan trọng hiện đang được các tổ chức quốc tế sử dụng, chẳng hạn như Ủy ban Khoa học Liên hợp quốc về Tác động của Bức xạ Nguyên tử (UNSCEAR) và Ủy ban Quốc tế về Bảo vệ Xạ trị (ICRP), để suy rộng rủi ro sức khỏe có được từ dữ liệu dịch tễ học ở liều cấp tính cao hơn sang liều thấp và tỷ lệ liều thấp. Các khái niệm này về cơ bản là khả năng gây đột biến có hại của bức xạ ion hóa và sự phụ thuộc tuyến tính vào liều của nó ở mức phơi nhiễm thấp. Đặc biệt, vai trò cơ bản của tổn thương DNA do bức xạ gây ra trong việc gây ra đột biến và quang sai nhiễm sắc thể hiện đang được cho là khuôn khổ để phân tích các rủi ro ở liều bức xạ thấp và phơi nhiễm ở tỷ lệ liều thấp. Ngoài ra, đối với việc gây ra ung thư và bệnh di truyền ở liều thấp/tỷ lệ liều thấp, việc sử dụng mối quan hệ tuyến tính giữa các mức tăng liều và rủi ro gia tăng được coi là một giả định hợp lý về mặt khoa học, ngay cả khi có những bất ổn liên quan đến phán đoán này được thừa nhận.
Tuy nhiên, các phản ứng sinh học phóng xạ phi tuyến tính có thể có liên quan ở mức phơi nhiễm thấp cũng xem xét trong nhiều năm, chẳng hạn như “hiệu ứng không nhắm mục tiêu” (NTE) và phản ứng thích ứng phóng xạ (AR). Hiện nay đã xác định rõ ràng rằng bức xạ ion hóa, bên cạnh các đột biến gen, cũng có thể gây ra các biến đổi biểu sinh. Trên thực tế, các sự kiện biểu sinh được biết là điều chỉnh hoạt động và biểu hiện của gen không chỉ trong quá trình phát triển và biệt hóa mà còn để đáp ứng với các kích thích của môi trường, chẳng hạn như bức xạ ion hóa. Điều thú vị là có bằng chứng cho thấy NTE và AR có mối quan hệ liên quan với nhau và thậm chí là khả năng các cơ chế biểu sinh có thể đóng vai trò trong đó. Bằng chứng cho thấy các hiện tượng sinh học như vậy không phù hợp với mô hình sinh học phóng xạ cổ điển, mà hệ thống bảo vệ bức xạ được quốc tế thống nhất hiện đang dựa trên, đã dẫn đến nhiều cuộc thảo luận về việc liệu mô hình này có nên được sửa đổi hay không. Một số bài đánh giá về các khía cạnh lịch sử và phương pháp luận của sự tiến hóa mô hình sinh học phóng xạ và tác động của bức xạ ion hóa lên quá trình metyl hóa DNA.
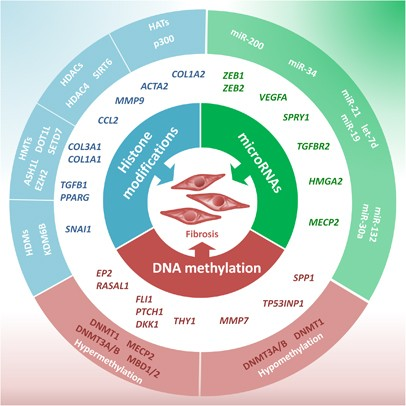
Đến nửa sau của thế kỷ trước, người ta đã nhận ra rằng bản thân DNA không quyết định mọi đặc điểm của một sinh vật, bao gồm cả con người. Vai trò của những đặc điểm đó quyết định quan trọng đến việc gen nào được biểu hiện trong từng loại tế bào (đặc điểm “biểu sinh”). Thuật ngữ “biểu sinh học” được đặt ra vào năm 1942 nhưng cách sử dụng hiện đại của nó khá mới và đã được sử dụng với nhiều ý nghĩa khác nhau. Định nghĩa hiện đại về biểu sinh học là “nghiên cứu về những thay đổi có thể di truyền theo nguyên phân và/hoặc giảm phân trong chức năng gen mà không thể giải thích được bằng những thay đổi trong trình tự DNA” và đặc điểm biểu sinh (epigenome) của một sinh vật được coi là “kiểu hình có thể di truyền ổn định do những thay đổi trong nhiễm sắc thể mà không có sự thay đổi trong trình tự DNA”.
Các sự kiện biểu sinh được biết là điều chỉnh hoạt động và biểu hiện của gen trong quá trình phát triển và biệt hóa. Đặc biệt, các cơ chế biểu sinh điều chỉnh biểu hiện gen trong các tế bào của cơ thể chúng ta để tạo ra tất cả các loại tế bào khác nhau, mặc dù chúng có cùng bộ gen. Tuy nhiên, chúng cũng ảnh hưởng đến biểu hiện gen để đáp ứng với các kích thích của môi trường, bao gồm cả bức xạ ion hóa. Do đó, biểu sinh được coi là cầu nối giữa kiểu gen và kiểu hình. Các cơ chế di truyền, chẳng hạn như đột biến, có thể di truyền, nhưng không dễ bị ảnh hưởng hoặc bị chi phối bởi ảnh hưởng của môi trường (ngay cả khi đột biến có thể được gây ra bởi bức xạ môi trường, chúng là những sự kiện tương đối hiếm). Ở thái cực khác, có những con đường chuyển hóa, phản ứng với những thay đổi của môi trường thông qua sự tương tác của các tác nhân hóa học hoặc các tác nhân gây căng thẳng khác với các protein liên quan đến biểu hiện gen, không thể di truyền. Thay vào đó, các sửa đổi biểu sinh dễ bị ảnh hưởng bởi sự thay đổi của môi trường và đồng thời có thể di truyền. Một khía cạnh thú vị là chúng có thể tồn tại sau khi tác nhân gây căng thẳng bị loại bỏ, nhưng chúng cũng có thể đảo ngược được. Những thay đổi biểu sinh chính hiện đang được xem xét là quá trình metyl hóa DNA, sửa đổi histone và điều chế RNA không mã hóa (ncRNA).
Những phát hiện ban đầu thu được vào cuối những năm 1980 chỉ ra rằng việc tiếp xúc với bức xạ γ 60Co gây ra sự giảm metyl hóa DNA phụ thuộc vào liều lượng, xét về mức độ 5-mC, trong một số dòng tế bào nuôi cấy. Kể từ đó, một lượng lớn nghiên cứu được thực hiện cả trong ống nghiệm và trong cơ thể sống cho thấy tia X hoặc tia γ có thể thay đổi kiểu metyl hóa DNA. Các nghiên cứu trên tế bào người nuôi cấy cho thấy bức xạ LET thấp gây ra tình trạng giảm metyl hóa DNA, biểu hiện các cấu hình khác nhau ở tế bào người nuôi cấy kháng bức xạ và nhạy bức xạ. Các nghiên cứu trên động vật, đặc biệt là trên mô hình động vật gặm nhấm, chỉ ra rằng bức xạ LET thấp gây ra tình trạng giảm metyl hóa DNA toàn cầu không phổ biến ở các mô và tế bào khác nhau, xảy ra theo cách phụ thuộc vào liều lượng, giới tính và mô cụ thể và có thể dai dẳng.
Nhìn chung, các dữ liệu này chỉ ra rằng việc tiếp xúc với bức xạ LET thấp dẫn đến tình trạng giảm methyl hóa DNA. Tuy nhiên, điều quan trọng là phải xác định xem tình trạng giảm methyl hóa có phân bố đồng đều trên toàn bộ bộ gen hay không và liệu có tình trạng tăng methyl hóa locus cụ thể hay không, tình trạng này được biết là có liên quan đến trạng thái chromatin không hoạt động và trong hầu hết các trường hợp là hoạt động biểu hiện gen bị ức chế. Cần lưu ý rằng phần lớn bộ gen của sinh vật nhân chuẩn bao gồm các yếu tố lặp lại (RE), trong khi chỉ có ít hơn 2% được chiếm bởi các gen mã hóa protein. Các RE không mã hóa, đặc biệt là các yếu tố được gọi là yếu tố chuyển vị (TE), cung cấp một nguồn điều hòa gen dồi dào. Tình trạng giảm methyl hóa của chúng, đặc biệt là ở các vùng được gọi là “Yếu tố Nucleotide xen kẽ dài 1” (LINE-1), đã được quan sát thấy ở hầu hết các bệnh ung thư ở người và thường tiên lượng xấu. Mất methyl hóa DNA ở TE làm tăng hoạt động phiên mã để việc tái hoạt hóa TE có khả năng dẫn đến GI, được coi là dấu hiệu chính của nhiều loại ung thư. Nhiều bằng chứng chứng minh rõ ràng rằng những thay đổi trong methyl hóa và biểu hiện TE là do tiếp xúc với các tác nhân gây căng thẳng trong môi trường, nhiều trong số đó là chất gây ung thư hoặc nghi ngờ là chất gây ung thư, do đó người ta đề xuất rằng TE có thể đóng vai trò là dấu ấn sinh học của việc tiếp xúc với các tác nhân gây căng thẳng trong môi trường. Tuy nhiên, tình trạng tăng methyl hóa TE cũng đã được phát hiện trong một số thí nghiệm trong ống nghiệm, cho thấy rằng những thay đổi trong trạng thái methyl hóa TE phụ thuộc vào mô, liều lượng và chất lượng bức xạ. Tăng methyl hóa gen cụ thể thường liên quan đến các đảo CpG thường không được methyl hóa và có thể liên quan đến sự im lặng phiên mã của gen tương ứng. Nếu đó là gen ức chế, thì việc mất chức năng của nó có thể là một sự kiện quan trọng góp phần vào quá trình gây ung thư. Trên thực tế, một số nghiên cứu đã chứng minh tình trạng tăng methyl hóa DNA đáng kể của các gen ức chế khối u ở những công nhân tiếp xúc với bức xạ ion hóa. Ngoài ra, những thay đổi methyl hóa DNA đặc hiệu gen đã được tìm thấy trong các tế bào ung thư vú của con người được chiếu xạ bằng tia X. Điều thú vị là những thay đổi methyl hóa khác biệt này tương quan với các phản ứng sinh học đã biết đối với bức xạ, chẳng hạn như những phản ứng trên chu kỳ tế bào, sửa chữa DNA và apoptosis.
Biến đổi histone do bức xạ gây ra
Tế bào tiếp xúc với bức xạ ion hóa dẫn đến nhiều biến đổi histone khác nhau. Một biến đổi histone do bức xạ gây ra nổi tiếng là phosphoryl hóa histone H2AX, cực kỳ quan trọng đối với việc sửa chữa các đứt gãy chuỗi đôi DNA và duy trì sự ổn định của bộ gen. Quá trình phosphoryl hóa histone này tại serine 139 (γ-H2AX) là phản ứng sớm của tế bào đối với bức xạ ion hóa và được sử dụng làm thước đo DSB. Trong mô hình chuột sống, chiếu xạ tia X liều thấp dẫn đến giảm tri-methyl hóa histone H4 trong tuyến ức kèm theo giảm tổng thể độ chặt của chromatin, tăng đáng kể tình trạng giảm methyl hóa DNA toàn cầu cũng như tích tụ tổn thương DNA và liên quan đến việc giảm biểu hiện DNMT. Các biến đổi histone tương tự đã được tìm thấy trong ung thư vú ở người. Những phát hiện này chứng minh rằng những thay đổi do bức xạ gây ra trong quá trình metyl hóa DNA và sửa đổi histone dẫn đến GI tổng thể. Hơn nữa, người ta đã chỉ ra rằng việc sửa đổi chromatin bằng cách acety hóa histone cũng rất quan trọng đối với quá trình sửa chữa DNA và acety hóa chromatin liên quan đến một số bước quan trọng như tái cấu trúc chromatin và gắn thẻ DSB, kích hoạt các chất điều hòa sửa chữa, điều hòa chu kỳ tế bào và apoptosis.
Liều lượng bức xạ ảnh hưởng đến những thay đổi biểu sinh
Hầu hết các nghiên cứu về tác động của việc tiếp xúc với bức xạ lên epigenome đều tập trung vào tác động của tia X hoặc tia γ có LET thấp. Ngược lại, rất ít nghiên cứu đánh giá tác động của bức xạ có LET cao lên epigenome. Mối quan tâm ngày càng tăng đối với các cơ chế cơ bản đằng sau các tác động sinh học của bức xạ có LET cao đã được thúc đẩy gần đây bởi cuộc điều tra về rủi ro sức khỏe do bức xạ không gian gây ra trong các sứ mệnh không gian có người lái và việc đưa bức xạ có LET cao vào thực hành lâm sàng (liệu pháp hadron). Nhóm của Morgan đã giải quyết cụ thể vấn đề so sánh giữa các tác động biểu sinh do bức xạ có LET thấp và cao gây ra. Người ta kỳ vọng rằng bức xạ có LET cao có khả năng gây ra những tác động độc đáo lên epigenome, do các đặc điểm độc đáo của cấu trúc đường dẫn của nó. Trên thực tế, hiện nay có một số nghiên cứu cho thấy việc tiếp xúc với bức xạ LET cao có thể dẫn đến những thay đổi lâu dài về tổng mức độ metyl hóa DNA và biểu hiện miRNA, có thể khác với những thay đổi do liều lượng tương đương của bức xạ LET thấp gây ra.
Một số nghiên cứu tập trung vào tác động của các hạt năng lượng và điện tích cao (HZE), chẳng hạn như các ion Fe năng lượng cao (thường là 600–1000 MeV/u, LET 180–150 keV/μm), vì chúng đại diện cho thành phần có hại nhất của bức xạ không gian liên quan đến rủi ro sức khỏe mà các phi hành gia gặp phải trong không gian sâu. So sánh giữa việc tiếp xúc với tia X và ion Fe LET cao của các tế bào nuôi cấy cho thấy ion Fe gây ra nhiều tổn thương nhiễm sắc thể và tiêu diệt tế bào hơn tia X. Methyl hóa DNA toàn cầu bị ảnh hưởng theo một cách khác, vì tăng methyl hóa được tìm thấy trong các tế bào nuôi cấy tăng gấp đôi 16–20 lần sau khi tiếp xúc với proton và ion Fe LET cao trái ngược với giảm methyl hóa đối với các tế bào tiếp xúc với tia X. Tăng methyl hóa DNA toàn cầu cũng được xác nhận sau khi tiếp xúc với ion Fe ở mô hình chuột. Điều thú vị là các proton năng lượng cao có LET tương đối thấp tạo ra hiệu ứng tương tự như hiệu ứng do các ion Fe LET cao gây ra, cho thấy rằng phản ứng biểu sinh đối với bức xạ có thể dựa trên chất lượng bức xạ hơn là LET. Một lời giải thích khả thi cho sự khác biệt giữa bức xạ ion hóa thưa thớt và dày đặc xuất phát từ sự khác biệt có thể có về ứng suất oxy hóa hoặc từ các quan sát rằng quá trình metyl hóa DNA ổn định có thể xảy ra tại các vị trí sửa chữa đứt gãy DNA, có khả năng được tạo ra với năng suất cao hơn bởi bức xạ ion hóa dày đặc.
Tuy nhiên, sau khi tiếp xúc với ion Fe-LET cao, tình trạng giảm methyl hóa TE được phát hiện trong cùng các tế bào nuôi cấy có tình trạng tăng methyl hóa. Các thí nghiệm in vivo được thực hiện trên các mô hình chuột được chiếu xạ bằng ion Fe cho thấy một bức tranh phức tạp: giảm hoặc tăng methyl hóa ở TE phụ thuộc vào cơ quan được phân tích và thời gian quan sát. Người ta cũng làm rõ rằng tình trạng tăng methyl hóa DNA của các yếu tố LINE-1 được tìm thấy trong phổi của chuột được chiếu xạ bằng ion Fe phụ thuộc vào độ tuổi tiến hóa của chúng. Hiện tại, có rất ít thông tin về tác động của bức xạ LET cao đối với tình trạng methyl hóa ở các gen cụ thể. Các thí nghiệm in vitro cho thấy tình trạng tăng hoặc giảm methyl hóa hoặc không có thay đổi nào ở các vùng khởi động của các vị trí cụ thể được sử dụng làm dấu ấn sinh học để phát hiện sớm quá trình gây ung thư. Những khác biệt được quan sát có thể liên quan đến sự khác biệt về loại tế bào, liều lượng/tỷ lệ liều lượng, thời gian quan sát hoặc xét nghiệm được sử dụng.
Trong mô hình chuột được chiếu xạ bằng ion Fe, người ta đã báo cáo rằng hàm lượng 5-mC tăng lên, tuy nhiên, hàm lượng này không liên quan đến việc tăng metyl hóa DNA trong một nhóm gen ức chế khối u thường xuyên bị tăng metyl hóa và bất hoạt trong ung thư phổi. Một số thông tin có được từ dữ liệu của con người về những công nhân tiếp xúc. Người ta đã tìm thấy tình trạng tăng metyl hóa DNA đáng kể của kinase phụ thuộc cyclin CDKN2A và của gen methyltransferase DNA MGMT trong đờm của những người thợ mỏ urani tiếp xúc với radon. Phân tích này cũng được đề xuất để dự đoán ung thư phổi. Một nghiên cứu khác phát hiện thấy mức tăng metyl hóa p16 cao trong ung thư biểu mô tuyến phổi từ những công nhân tiếp xúc với plutonium tại nhà máy điện hạt nhân MAYAK của Nga. Tuy nhiên, những kết quả này nên được coi là định tính, vì không dễ để định lượng mức phơi nhiễm LET cao trong những trường hợp này. Người ta cũng phát hiện ra rằng chất lượng bức xạ phụ thuộc vào tác động lên biểu hiện miRNA. Trong các tế bào nuôi cấy, chiếu xạ ion Fe gây ra tỷ lệ thay đổi mức độ biểu hiện miRNA thấp hơn so với tia X, một kết quả khá đáng ngạc nhiên khi xét đến hiệu quả cao hơn của ion Fe đối với tổn thương nhiễm sắc thể và tiêu diệt tế bào. Chiếu xạ bằng proton năng lượng cao, tia γ hoặc ion Fe trong máu chuột dẫn đến các sửa đổi theo loại bức xạ và liều lượng cụ thể của một nhóm 31 miRNA, do đó, mức độ các dấu hiệu biểu hiện miRNA có nguồn gốc từ máu chuột được đề xuất là một dấu ấn sinh học cho việc tiếp xúc với proton năng lượng cao.
Từ khóa: bức xạ;
– CMD –