Một phương pháp mới để nghiên cứu chuyển động của protein đã được phát triển bởi các nhà nghiên cứu tại Đại học Umeå và Phòng thí nghiệm MAX IV ở Lund. Phương pháp này cho phép thực hiện nhiều thí nghiệm hơn so với trước đây và cho phép chúng ta tìm hiểu thêm về các quá trình quan trọng trong tế bào của con người, động vật và thực vật. Công trình được công bố trên Tạp chí Structure.
Protein phải di chuyển để thực hiện các nhiệm vụ sinh học trong tế bào. Những chuyển động như vậy gọi là động lực học (chuyển động) của protein và được mã hóa theo trình tự axit amin của protein thông qua quá trình tiến hóa. Chuyển động của protein rất cần thiết cho chức năng sinh học và các phương pháp xác định sự sắp xếp lại cấu trúc như vậy tạo thành một biên giới trong sinh học cấu trúc. Bức xạ synchrotron có thể theo dõi động lực học của protein theo thời gian thực, nhưng khả năng tiếp cận các chùm tia X phân giải thời gian xung tia X đơn thông lượng cao chuyên dụng là rất khó, các mục tiêu nghiên cứu về protein sửa đổi theo đặc tính đó bị hạn chế.
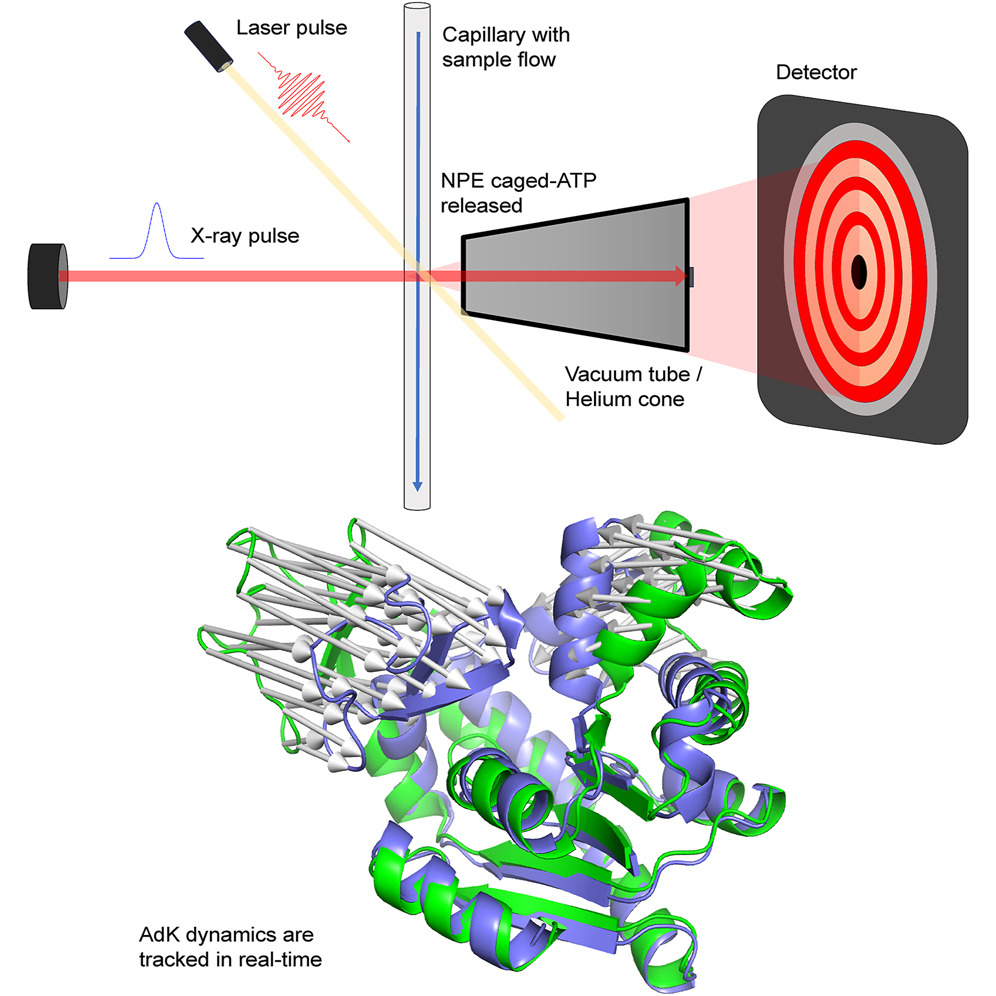
Những hạn chế này có thể được giảm bớt bằng cách kích hoạt phản ứng hợp chất lồng do tia laser gây ra và thăm dò động lực học cấu trúc bằng các thiết bị thu nhận tia X. Trong nghiên cứu này, các nhà khoa học đã thiết lập hệ tán xạ tia X theo thời gian (TR-XSS) trên đường truyền chùm tia CoSAXS tại synchrotron Phòng thí nghiệm MAX IV. Quá trình kích hoạt ATP lồng ghép bắt đầu bằng tia laser trong enzyme adenylate kinase (AdK) và phản ứng được theo dõi trong thời gian lên tới 50 mili giây với độ phân giải thời gian 2 mili giây đạt được nhờ kết quả đọc của máy dò. Tín hiệu cấu trúc được phân giải theo thời gian của protein cho thấy tác động phá hủy bức xạ tối thiểu và phù hợp với dữ liệu được thu thập bằng phương pháp xung tia X.
Các thí nghiệm tán xạ tia X (TR-XSS) theo thời gian có thể ghi lại sự sắp xếp lại cấu trúc quy mô lớn trong cả protein hòa tan và protein màng. Hai phương pháp chính được sử dụng để đạt được độ phân giải thời gian: (1) bơm và đầu dò có xung tia X ngắn được cách ly bằng thiết bị quay (phương pháp xung tia X cách ly) hoặc (2) đầu dò tia X liên tục và sử dụng tốc độ đọc nhanh từ máy dò để thu được độ phân giải thời gian (phương pháp máy dò). Phương pháp xung tia X cô lập sẽ tách các xung tia X đơn lẻ từ pico đến micro giây khỏi vòng lưu trữ synchrotron để đạt độ phân giải thời gian. Kết quả là, việc tiếp xúc với tia X với mẫu được giảm thiểu và do đó giảm thiểu thiệt hại do bức xạ. Chỉ một phần tạm thời của cường độ chùm tia X là có thể thăm dò mẫu sau khi kích hoạt tia laser, nên mỗi tổ hợp xung laser/tia X cần lặp lại nhiều lần để đạt được mức tín hiệu phù hợp trên nhiễu. Việc sử dụng dòng mẫu liên tục yêu cầu thể tích mẫu lớn. Việc dịch mao dẫn qua chùm tia X sau đó bổ sung mẫu cho mỗi thí nghiệm có thể giảm thiểu yêu cầu này. Tuy nhiên, độ trễ trong thời gian dài sẽ làm tăng đáng kể thời gian thu thập dữ liệu. Phương pháp xung tia X cô lập được kích hoạt bằng một thiết lập rất tinh vi và được thực hiện ở rất ít trạm synchrotron trên toàn thế giới.
Trong các thử nghiệm TR-XSS sử dụng phương pháp máy dò, mẫu phải chịu sự phơi nhiễm chùm tia đơn sắc, liên tục trong quá trình thu thập dữ liệu, giúp tăng cường mức tín hiệu trên nhiễu và do đó giảm thể tích mẫu cần thiết cũng như thời gian cần thiết để thu thập dữ liệu. Sau khi kết thúc chuỗi thời gian thu nhận tia X, cửa sổ tia X được bổ sung mẫu mới và tiếp theo là chu trình bơm và đầu dò tia X/laser mới. Độ phân giải tạm thời được đặt theo thời gian đọc của máy dò, thường nằm trong khoảng từ micro đến mili giây. Ưu điểm chính của phương pháp TR-XSS này là có thể sử dụng tia X đơn sắc synchrotron phổ biến hơn, giúp giảm bớt hạn chế trong việc tiếp cận các cơ sở synchrotron quy mô lớn.
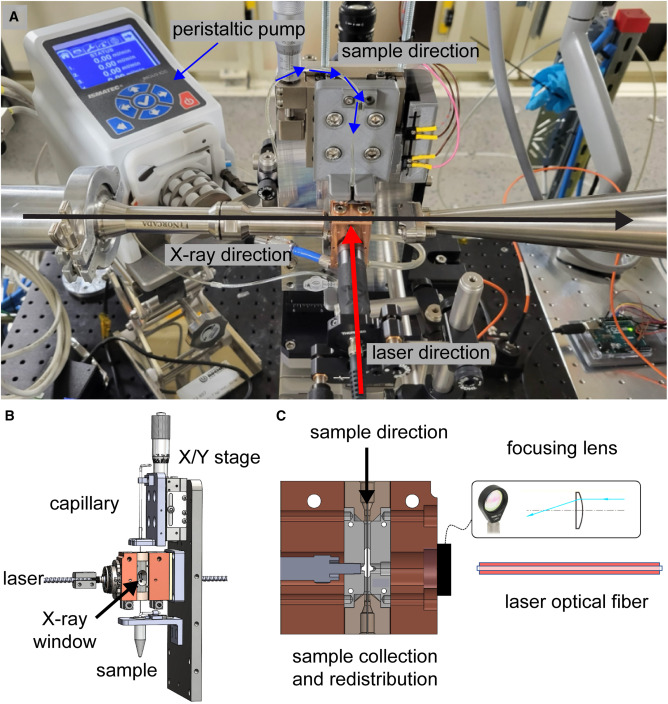
Ưu điểm của phương pháp này là giảm nhu cầu về số lượng mẫu và tăng khả năng tiếp cận của các nhà nghiên cứu, có thể đạt được kết quả tương tự như phương pháp xung tia X riêng biệt. Điều quan trọng là, phương pháp TR-XSS được phát triển bằng cách kích hoạt giải phóng ATP do tia laser gây ra từ lồng không bền với ảnh của nó, tức là một phản ứng không thể đảo ngược. Việc sử dụng hợp chất lồng cho phép kích hoạt laser gián tiếp các protein vốn không được kích hoạt bằng ánh sáng. ATP lồng đã được sử dụng trong các thí nghiệm TR-XSS để kích hoạt quá trình giảm thiểu protein phụ thuộc ATP của miền liên kết nucleotide MsbA, đóng miền trong enzyme adenylate kinase, và các cấu trúc trung gian của chất vận chuyển canxi protein màng SERCA1a. Phát triển lồng mới với các hợp chất có thể được kích hoạt một cách hiệu quả bằng tia X cho các tác dụng phụ tối thiểu gây ra bởi tính chất hóa học của lồng. Cho rằng các hợp chất trong lồng như vậy có thể kích hoạt một loạt các phản ứng hóa học và sinh học, nó sẽ có giá trị trong việc phát triển TR-XSS để theo dõi các phản ứng không thể đảo ngược.
Từ khóa: tia X; synchrotron; protein;
– CMD&DND –