Ung thư là một trong những nguyên nhân gây tử vong hàng đầu trên thế giới. Trong những thập kỷ qua, các liệu pháp nhắm mục tiêu hay xạ trị nổi lên là phương pháp điều trị có chọn lọc các tế bào “bị bênh” và hạn chế tổn thương các tế bào khỏe mạnh. Vật liệu nano với diện tích bề mặt lớn, dễ chức năng hóa và có đặc tính lý hóa đặc biệt, được coi là chất mang phóng xạ tiềm năng cho trị liệu. Các đặc tính quang học, điện tử và từ tính của chúng có thể được bổ sung bằng bức xạ ion hóa để tạo thành các tác nhân trị liệu theranostic (trị liệu và chẩn đoán) hoặc kết hợp.
Điều trị ung thư hiện đang được thực hiện với nhiều phương pháp, nhiều chiến lược, như phẫu thuật, hóa trị, xạ trị hoặc kết hợp các phương pháp này. Khi tiếp xúc với bức xạ ion hóa, DNA của tế bào “bệnh” sẽ cản trở sự phát triển của tế bào và thường dẫn đến chết tế bào. Bức xạ này có thể được truyền theo hai cách: từ nguồn tia γ hoặc tia X bên ngoài (xạ trị chùm tia ngoài, EBRT) hoặc trực tiếp từ bên trong khối u bằng cách đưa hạt phóng xạ (xạ trị áp sát) vào trong cơ thể hoặc tiêm các chất phóng xạ vào cơ thể. Cả hai chiến lược đó đều có thể được sử dụng riêng lẻ hoặc kết hợp với các chiến lược điều trị khác. Xạ trị ngoài có độ đặc hiệu thấp đối với tế bào ung thư, có thể gây tổn thương cho các tế bào khỏe mạnh trên đường đi của nó và hạn chế vùng tiếp xúc. Xạ trị áp sát đòi hỏi phải biết rất chính xác vị trí của khối u.
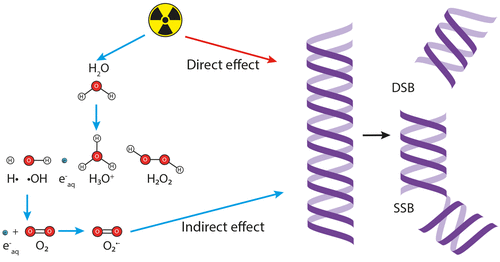
Bức xạ ion hóa tiêu diệt tế bào ung thư bằng cách gây tổn thương cho nhiều thành phần tế bào, bao gồm cả phân tử DNA, thông qua các cơ chế khác nhau. Nó có thể tác động trực tiếp lên các phân tử DNA hoặc gián tiếp bằng cách tạo ra các gốc tự do được gọi là các loài oxy phản ứng (ROS), có nguồn gốc từ quá trình ion hóa các phân tử nước, sau đó tấn công DNA. Các tổn thương dẫn đến chết tế bào nếu không được sửa chữa được phân loại thành hai loại: đứt gãy sợi đơn (SSB) và đứt gãy sợi đôi (DSB), trong đó loại sau là cơ chế gây chết cao nhất trong hai cơ chế.
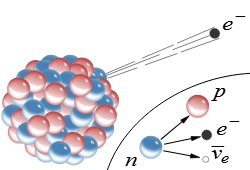
Mặc dù bức xạ ion hóa có hiệu quả trong việc tiêu diệt tế bào ung thư, nhưng việc sử dụng nó cũng ảnh hưởng đến các tế bào khỏe mạnh. Trong quá trình điều trị bằng chùm tia bên ngoài, tất cả các mô xung quanh khối u cũng bị ảnh hưởng và có thể bị tổn thương. Vấn đề này ít nghiêm trọng hơn khi áp dụng liệu pháp xạ trị gần vì hạt được cấy trực tiếp vào khối u. Tuy nhiên, không phải tất cả các khối u đều có thể phẫu thuật được. Để khắc phục những hạn chế đó, các chiến lược mới nhắm vào các tế bào ung thư đang được nghiên cứu để đạt được các phương pháp điều trị đặc hiệu cho khối u. Không giống như EBRT, xạ trị nội khoa dựa vào các hợp chất được tiêm toàn thân gắn các chất phóng xạ tích tụ tại vị trí khối u, chiếu xạ khối u từ bên trong và bảo vệ các tế bào khỏe mạnh xung quanh. Các chất phóng xạ trị liệu được phân loại tùy thuộc vào loại phân rã và các hạt phát ra: các hạt α và β– và các electron năng lượng thấp. Các hạt α là hạt nhân heli-4 tích điện bao gồm hai proton và hai neutron (4He2+) được phát ra trong quá trình phân rã phóng xạ của các chất phóng xạ nặng. Chúng có khả năng truyền năng lượng tuyến tính (LET) cao, tương ứng với mật độ ion hóa dọc theo đường đi của hạt tích điện di chuyển. Khoảng cách di chuyển của chúng trong mô nằm trong khoảng từ 28 đến 100 μm, nghĩa là năng lượng được giải phóng trong phạm vi đường kính từ 5–10 tế bào, hạn chế tổn thương cho các tế bào mục tiêu và các tế bào lân cận gần (hiệu ứng bắn chéo). Các hạt α chủ yếu nhắm vào DNA thông qua quá trình ion hóa trực tiếp, gây ra DSB. Hoạt động của các hạt α không phụ thuộc vào sự hiện diện của oxy, khiến chúng phù hợp hơn để điều trị các khối u thiếu oxy.
Các hạt β– là các electron năng lượng cao được phát ra trong quá trình phân rã của các hạt phóng xạ giàu neutron với một hạt cho mỗi lần phân rã. Không giống như phân rã α, dẫn đến phát xạ các hạt đơn năng, phân rã β– dẫn đến phát xạ các hạt có sự phân bố năng lượng liên tục. Các hạt đó có LET thấp hơn nhưng phạm vi trong mô cao hơn (2–10 mm) so với các hạt α. Chiếu xạ chéo của các hạt đó cao hơn so với các hạt α vì phạm vi của chúng lớn hơn. Do đó, không cần phải nhắm mục tiêu vào tất cả các tế bào trong khối u miễn là tất cả các tế bào đều nằm trong phạm vi của các hạt phóng xạ đang phân rã. Không giống như các hạt α và electron Auger, các hạt β– chủ yếu gây ra sự hình thành ROS, gây tổn thương cho DNA của tế bào. Electron Auger và electron chuyển đổi là các electron năng lượng thấp được phát ra bởi một số hạt phóng xạ trong quá trình phân rã sau khi chuyển đổi nội bộ (IC) hoặc bắt electron (EC). Chúng có năng lượng thấp hơn (<25 keV) và phạm vi mô (<0,5 μm) nhỏ hơn so với các hạt β– nhưng có LET cao. Do phạm vi thấp của chúng, các electron Auger phải được phát ra gần nhân tế bào để gây ra tổn thương hữu ích. Tuy nhiên, không giống như các hạt α và β–, nhiều electron năng lượng thấp được phát ra trong mỗi lần phân rã.
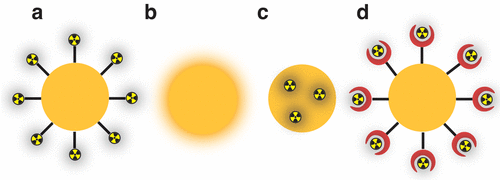
Vật liệu nano, trong đó ít nhất một chiều nằm dưới 100 nm, đã xuất hiện trong vài thập kỷ qua nhờ các tính chất quang học, từ tính và điện tử độc đáo của chúng so với vật liệu khối. Do tỷ lệ bề mặt trên thể tích cao và dễ chức năng hóa, chúng cũng đang được nghiên cứu cho nhiều ứng dụng khác nhau trong y học. Vật liệu nano liên quan đến y tế có hai bản chất: hữu cơ (micelle, liposome, polyme, v.v.) và vô cơ (các đồng vị C, Au, oxit kim loại, v.v.). Trong khi các hạt nano vô cơ thường được hình thành do sự kết tủa của các muối vô cơ hoặc sự khử các ion kim loại, thì các hạt nano hữu cơ bao gồm các phân tử hữu cơ tự tổ chức, được liên kết với nhau bằng các tương tác yếu, ngoại trừ các dendrimer, là các phân tử đơn. Do bản chất của các tương tác đó, các hạt nano hữu cơ là các hệ thống động: chúng có thể hợp nhất với nhau, phát triển và tạo thành các hạt lớn hơn. Không giống như các hạt nano vô cơ, có thể nhỏ bằng một vài nguyên tử, một số hạt nano hữu cơ bị giới hạn bởi kích thước của các thành phần phân tử của chúng. Một số hạt nano vô cơ có khả năng sử dụng các đặc tính quang điện tử của chúng để tăng cường kết quả điều trị bằng cách kết hợp xạ trị và các hình thức khác như liệu pháp quang nhiệt, tăng nhạy cảm với tia xạ và tác nhân trị liệu (kết hợp giữa điều trị và chẩn đoán).

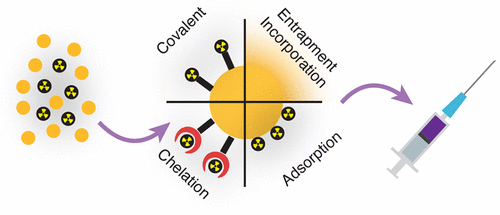
Có nhiều chiến lược khác nhau để đánh dấu phóng xạ các hạt nano, trong đó phổ biến nhất là sử dụng các chất tạo phức hai chức năng. Đó là các hợp chất có phối tử tạo phức liên kết với một nhóm chức năng được sử dụng để liên kết cộng hóa trị với các phân tử khác. Để có hiệu quả, chất tạo phức phải dễ dàng bám vào bề mặt của các hạt nano và cũng phải tạo thành một phức ổn định với chất phóng xạ quan tâm. Các nhóm chức năng có sẵn tự nhiên (hoặc nhân tạo) trên bề mặt của các hạt nano, chẳng hạn như hydroxyl và carboxyl, cũng có thể được sử dụng để tạo phức với kim loại. Ngoài ra, khả năng phản ứng của chất phóng xạ cũng có thể được sử dụng để tạo thành liên kết cộng hóa trị giữa các bề mặt (hoặc các phân tử được đặt trên bề mặt) của các hạt nano. Đây đặc biệt là trường hợp của halogen vì chúng có ái lực với một số kim loại như Au và Ag. Halogen cũng có thể được gắn vào các phân tử hữu cơ thông qua việc sử dụng các tác nhân oxy hóa như cloramin-T, iodogen và thuốc thử Bolton–Hunter. Các chất phóng xạ cũng có thể bị giữ lại trong các khoang có trong vật liệu nano, chẳng hạn như bên trong ống nano hoặc các lỗ rỗng của các hạt nano silica. Cuối cùng, hỗn hợp các tiền chất “lạnh” và “nóng” (ổn định và phóng xạ, ví dụ, HAuCl4 và [198Au]HAuCl4) có thể được sử dụng trong quá trình tổng hợp hoặc các hạt nano “lạnh” có thể được kích hoạt trong chùm tia neutron để tạo ra các hạt nano được gắn nhãn phóng xạ nội tại.
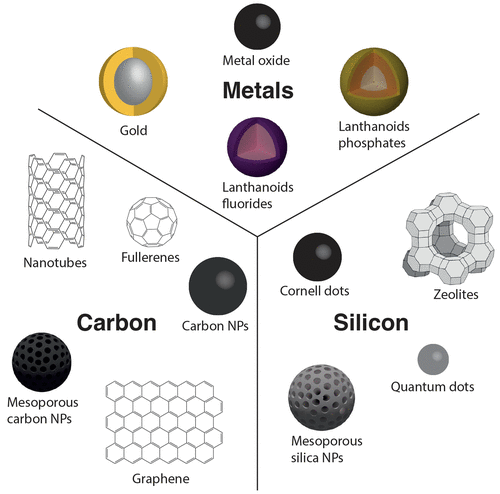
Khả năng điều chỉnh sự phân bố sinh học và dược động học của vật liệu nano cho phép phát triển các nanoconstruct nhắm mục tiêu thụ động, tích tụ tự nhiên trong khối u. Điều này được gọi là hiệu ứng tăng cường tính thấm và duy trì. Khi các tế bào ung thư nhân lên nhanh chóng, quá trình hình thành mạch máu được kích hoạt để cung cấp oxy và chất dinh dưỡng cho các tế bào đang phát triển. Không giống như các mạch máu bình thường, mạch máu mới bao gồm các tế bào nội mô không được sắp xếp và tổ chức kém, dẫn đến tình trạng tăng tính thấm của các mạch máu. Các hạt nano và phân tử lớn có thể thoát mạch và tích tụ, do thiếu hệ thống dẫn lưu bạch huyết, trong mô khối u bằng cách đi qua các lỗ nội mô. Hơn nữa, chức năng hóa bề mặt của các vật liệu nano như vậy với các phân tử (sinh học) nhắm mục tiêu cho phép cung cấp bức xạ ion hóa đặc hiệu cho khối u. Về vấn đề này, kích thước, hình dạng, điện tích bề mặt và tính chất hóa học của vật liệu nano nên được điều chỉnh để tránh sự kết tụ và hấp thụ của hệ thống lưới nội mô (RES; gan, lách và thận) và để tối đa hóa sự tích tụ và chiếu xạ của khối u. Các vật liệu nano được đề cập trong bài đánh giá này được phân loại thành dựa trên C hoặc Si, trong đó mỗi loại được cấu thành từ các loại khác nhau.
Một số hạt nano cho thấy sự phân bố sinh học kém và thường tích tụ trong thời gian dài ở các mô không phải mục tiêu như gan, lá lách và thận, làm giảm đáng kể liều dùng để tránh chiếu xạ vào các cơ quan khỏe mạnh. Để tránh điều này, một số hạt nano được tiêm vào khối u hoạt động như các tác nhân điều trị nanobrachytherapeutic. Tuy nhiên, nanoconstruct có thể di chuyển, độ ổn định không phải lúc nào cũng tối ưu và một số tích tụ ở các mô không phải mục tiêu vẫn có thể xảy ra. Việc tiêm đồng thời với tác nhân tạo gel có thể làm giảm bớt điều này và ngăn ngừa sự di chuyển. Kích thước và hình dạng của vật liệu nano cũng như thành phần của ma trận chức năng sinh học cũng đóng vai trò quan trọng trong quá trình phân bố sinh học và hồ sơ dược động học. Ngoài ra, việc sử dụng vectơ nhắm mục tiêu được khuyến khích vì nó đã được chứng minh là thúc đẩy quá trình nội bào hóa, do đó dẫn đến hiệu quả điều trị cao hơn. Tuy nhiên, việc bổ sung vectơ nhắm mục tiêu như vậy vào CNT không cải thiện kết quả điều trị và vẫn tích tụ trong phổi với tỷ lệ thanh thải thấp, dẫn đến các tác dụng phụ có thể xảy ra. Do đó, nên tránh sử dụng nanoconstruct như vậy trừ khi có thể cải thiện hồ sơ phân bố sinh học và dược động học.
Từ khóa: chiếu xạ;xạ trị;
– CMD –