Sự liên kết của các dược chất trong điều trị y học với các chất sinh học bao gồm kháng thể và albumin, có thể tăng cường chọn lọc việc phân tán thuốc đến các khối u rắn bên trong cơ thể bệnh nhân. Tuy nhiên, để đạt được khả năng hoạt hóa trong các khối u và tránh các mô khỏe mạnh vẫn là một thách thức. Sự hoạt động của các dược chất phóng xạ trong các mô ngoài mục tiêu có thể gây tổn hại cho nhiều cơ quan. Mới đây, các nhà khoa học đã tiến hành nghiên cứu để giải quyết vấn đề này bằng cách đưa ra phương pháp liên kết thuốc với khả năng phân tán khi điều trị bức xạ ion hóa. Chiếu xạ tia X tại chỗ ở liều chiếu phù hợp (8 Gy) tạo ra 50% dược chất (doxorubicin hoặc monomethyl auristatin E, MMAE) được giải phóng trong điều kiện thiếu oxy thường chịu tác động từ tình trạng kháng xạ trị. Phương pháp tiếp cận với các liên hợp thuốc kháng thể và albumin đã đạt được độc tính tế bào MMAE tăng gấp >2000 lần khi chiếu xạ.
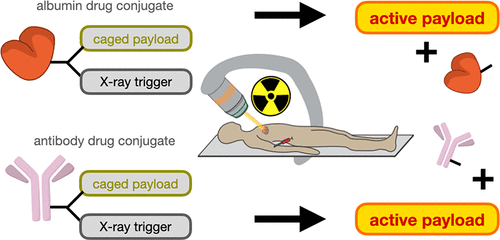
Nhiều phương pháp đã được phát triển để cải thiện chỉ số điều trị của các hợp chất phân tử nhỏ bằng cách liên kết chúng như tiền chất của dược chất với các chất sinh học hoặc hạt nano. Để điều trị ung thư di căn, các tác nhân gây độc tế bào đã được liên kết với huyết thanh albumin và hạt nano, cải thiện dược động học toàn thân và về nguyên tắc, thúc đẩy sự tích tụ khối u thông qua các cơ chế nhắm mục tiêu phân tử và/hoặc “tăng cường tính thấm và giữ lại” (EPR) của quá trình hấp thụ. Các cơ chế này bao gồm thúc đẩy macropinocytosis do oncogen, thấm mạch máu khối u, rối loạn chức năng hệ bạch huyết khối u và các đặc điểm khác góp phần vào hiệu ứng EPR. Ngoài ra, các phương pháp nhắm mục tiêu phân tử dựa trên kháng thể hoặc hạt nano chức năng hóa đã được thiết kế để liên kết với các thụ thể bề mặt một cách chọn lọc. Nhiều liên hợp kháng thể-thuốc (ADC) và hạt nano điều trị đã được FDA chấp thuận để sử dụng trong lâm sàng. Tuy nhiên, các tác nhân này vẫn tích tụ trong các mô ngoài mục tiêu và gây ra độc tính toàn thân. Thuốc nhận được cảnh báo khi chúng biểu hiện các tác dụng phụ có khả năng nghiêm trọng và gây tử vong, độc tính ảnh hưởng đến tủy xương, gan và các cơ quan khác đối với hầu hết các thuốc liên hợp trong ung thư.
Làm thế nào để giảm thiểu bức xạ ngoài mục tiêu cho các liên hợp thuốc phóng xạ, tối ưu hóa phương tiện vận chuyển – hạt sinh học hoặc hạt nano được liên kết. Sự tích tụ phóng xạ trong các cơ quan thanh thải và hệ thống thực bào đơn nhân có thể được giảm thiểu thông qua kỹ thuật PEGylation hoặc FcRn, nhưng dù sao vẫn khó loại bỏ hoàn toàn. Việc lựa chọn các mục tiêu phân tử khối u đặc hiệu thích hợp có thể cải thiện sự tích tụ có chọn lọc, nhưng trước tiên người ta cần xác định mục tiêu khối u đặc hiệu và thường chỉ một nhóm nhỏ khối u hoặc tế bào khối u có thể biểu hiện ưu tiên các mục tiêu như vậy. Tối ưu hóa hóa học mà tải trọng thuốc gắn vào phương tiện vận chuyển của nó đại diện cho một tập hợp các chiến lược khác. Việc giải phóng phóng xạ sớm hoặc ngoài mục tiêu góp phần vào việc tiếp xúc không đặc hiệu và/hoặc toàn thân, trong khi các liên kết không thể phân cắt có thể không tạo ra đủ lượng bức xạ hoạt động hoàn toàn trong khối u. Hầu hết các chiến lược hiện tại kiểm soát việc giải phóng bức xạ đều dựa vào độ pH, sự phân hủy lysosome, hoạt động của protease và các quá trình khác không phải là duy nhất đối với các tế bào khối u. Các phương pháp tiếp cận trực giao sinh học nhằm khắc phục những hạn chế về tính đặc hiệu sinh học bằng cách điều chỉnh hoạt động của thuốc theo cách độc lập với các quá trình hóa học tự nhiên. Các chiến lược được nghiên cứu trước đây để kích hoạt các tiền chất thuốc gây ung thư đã sử dụng các sơ đồ kích hoạt điện hóa, siêu âm, quang học, hóa chất và xúc tác kim loại chuyển tiếp. Nhìn chung, việc đạt được khả năng kiểm soát hoạt hóa thuốc ở mức độ cục bộ cao trong mô theo cách không xâm lấn là rất khó. Các phương pháp như nhiệt, siêu âm và chiếu xạ laser không dễ thâm nhập sâu vào mô và các chất kích hoạt hóa học trực giao sinh học có tính chọn lọc, khả năng tương thích cao hơn vẫn đang được nghiên cứu.
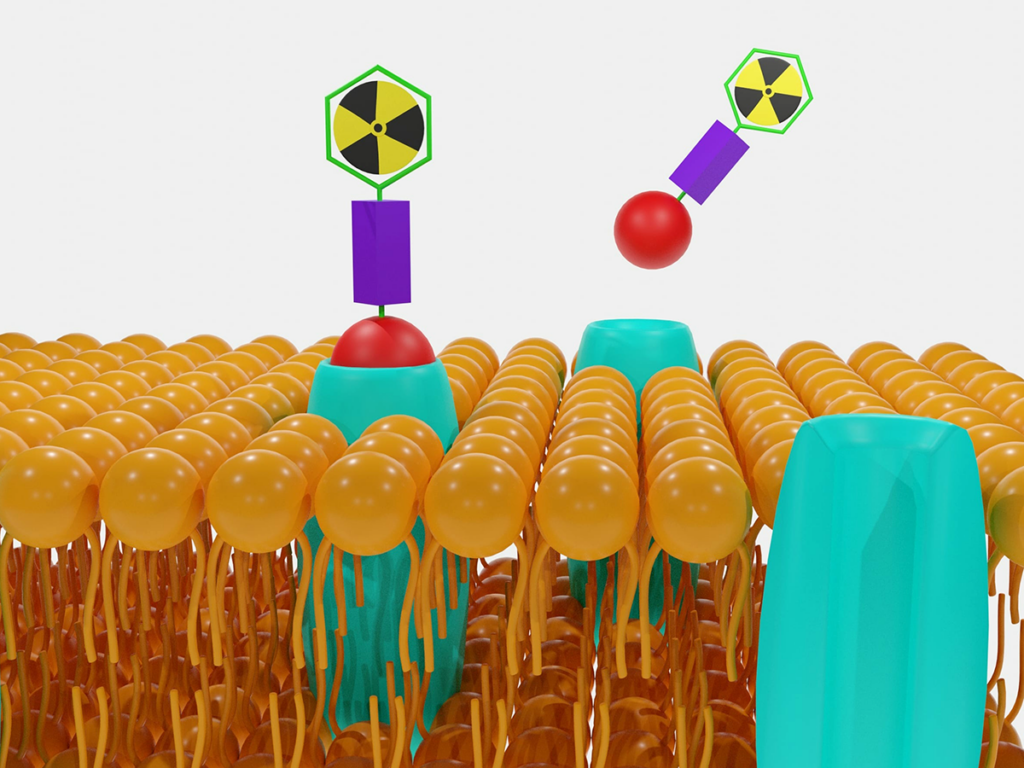
Ngược lại với những điều trên, bức xạ ion hóa đưa ra giải pháp hợp lý hơn: bức xạ thường được đưa sâu qua mô thông qua các chùm tia gamma, proton và tia X hội tụ. Các báo cáo gần đây đã mô tả các tiền chất thuốc bị nhốt được kích hoạt bằng bức xạ ion hóa, có thể liên hợp thuốc với kháng thể, albumin hoặc các phương tiện vận chuyển khác. Để khắc phục những hạn chế này, thiết kế tiền chất thuốc dạng mô-đun chứa một liên kết tự hủy với tải trọng gây độc tế bào, neo cho liên hợp protein và một tác nhân kích hoạt bức xạ. Một phần tử nhốt rượu 3,5-dimethylbenzyl (DMBA) trải qua quá trình loại bỏ 1–4/1–6 khi hydroxyl hóa gốc được khởi đầu thông qua liều chiếu xạ tia X có liên quan về mặt lâm sàng và trong điều kiện thiếu oxy, dẫn đến giải phóng tại chỗ >50% thuốc và tăng độc tính tế bào do thuốc gây ra >2000 lần. Thiết kế liên kết chung cung cấp tính linh hoạt trong cả phương diện nhắm mục tiêu và phân tán, hứa hẹn có thể áp dụng rộng rãi cho các ứng dụng phối hợp với bức xạ trong điều trị khối u thiếu oxy.
Công trình này mở rộng hoạt hóa bức xạ để hỗ trợ giải phóng kích hoạt các liên hợp thuốc sinh học. Giống như các liên kết ADC truyền thống, phương pháp này có thể được áp dụng cho nhiều loại phương tiện phân phối khác nhau như huyết thanh albumin hoặc các loại kháng thể; hơn nữa, nó có thể được áp dụng cho nhiều loại thuốc khác nhau, bao gồm các liệu pháp hóa trị độc tế bào được sử dụng rộng rãi là doxorubicin và MMAE. Phương pháp chỉ ra rằng sự cắt liên kết có thể được kích hoạt bởi nhiều dạng bức xạ ion hóa và được đẩy nhanh trong điều kiện thiếu oxy được cho là kích thích quá trình đại thực bào của các tác nhân liên kết với albumin. Bản thân bức xạ đã được chứng minh là cải thiện khả năng thâm nhập thuốc vào khối u và do đó mang lại khả năng tự khuếch đại cục bộ. Công trình này đặt nền tảng cho các công trình trong tương lai để điều tra các cơ chế hoạt hóa thuốc trong cơ thể sống và khả năng giải phóng ngoài mục tiêu, điều này sẽ yêu cầu (i) phân tích cẩn thận các hành vi hóa học và sinh học của thuốc trong khối u và mô ngoài mục tiêu, có và không có bức xạ; (ii) so sánh với thuốc tự do (không liên hợp) và tiền chất thuốc, cũng như thuốc liên hợp không thể phân cắt; và (iii) đánh giá hành vi của thuốc trong các mô hình khối u trực giao, có nguồn gốc từ bệnh nhân và/hoặc bản địa, mô phỏng lại các vi môi trường khối u thiếu oxy thường thấy ở bệnh nhân.

Công trình này cũng thiết lập nền tảng để đánh giá các thuốc liên hợp, ngoài MMAE và doxorubicin, có thể kết hợp hiệp đồng với các tác động sinh học của bức xạ. Mặc dù liều bức xạ điều trị được sử dụng ở đây được biết là gây ra tác động mạnh đến hành vi của tế bào ung thư, tuy nhiên, vẫn không tiêu diệt được khối u và ngăn chặn sự tiến triển của bệnh. Để đạt được mục đích, chiến lược thiết kế mô-đun có thể tối ưu hóa hơn nữa bộ kích hoạt tia X, neo liên hợp và thuốc. Phương pháp kỹ thuật tiền thuốc có thể được áp dụng cho nhiều liệu pháp khác nhau bao gồm các tác nhân điều hòa miễn dịch và chất ức chế nhắm mục tiêu được chọn để kết hợp hiệp đồng với bức xạ được sử dụng như một phần của tiêu chuẩn chăm sóc. Nghiên cứu đã đi sâu vào việc tìm hiểu cách thuốc nhắm mục tiêu DNA và vi ống có thể kết hợp tốt nhất với xạ trị, đặc biệt tập trung vào việc tối ưu hóa các tế bào ung thư để ở giai đoạn G2/M nhạy cảm với bức xạ trong chu kỳ tế bào của chúng và vào các hiệu ứng vi môi trường khối u giúp tối đa hóa quá trình oxy hóa.
Từ khóa: dược chất phóng xạ;
– CMD –