Hai thập kỷ qua đã mang lại sự thay đổi lớn trong cách điều trị nhiều loại ung thư. Các liệu pháp nhắm mục tiêu sẽ ngăn chặn các protein trong tế bào ung thư giúp chúng phát triển, phân chia và lan rộng. Liệu pháp miễn dịch kích thích hoặc ức chế hệ thống miễn dịch của cơ thể để giúp chống lại ung thư. Các phương pháp điều trị được sử dụng lâu dài – phẫu thuật, hóa trị và xạ trị – vẫn là phương pháp điều trị cốt lõi cho hầu hết các bệnh ung thư.
Xạ trị lần đầu tiên được sử dụng để điều trị ung thư đã xuất hiện cách đây hơn 100 năm. Khoảng một nửa số bệnh nhân ung thư đều trải qua xạ trị vào một thời điểm nào đó trong quá trình điều trị. Cho đến gần đây, hầu hết liệu pháp xạ trị vẫn được áp dụng giống như 100 năm trước, bằng cách đưa các chùm tia phóng xạ từ bên ngoài cơ thể vào để tiêu diệt các khối u bên trong cơ thể. Mặc dù hiệu quả nhưng xạ trị chiếu ngoài vẫn có thể gây ra các tác dụng phụ nguy hiểm. Ngay cả với thiết bị xạ trị hiện đại, tia bức xạ vẫn tác động tới các mô lành xung quanh khối u. Các tác dụng phụ của xạ trị phụ thuộc vào vùng cơ thể được điều trị nhưng có thể bao gồm mất vị giác, thay đổi da, rụng tóc, tiêu chảy và các vấn đề về tình dục.
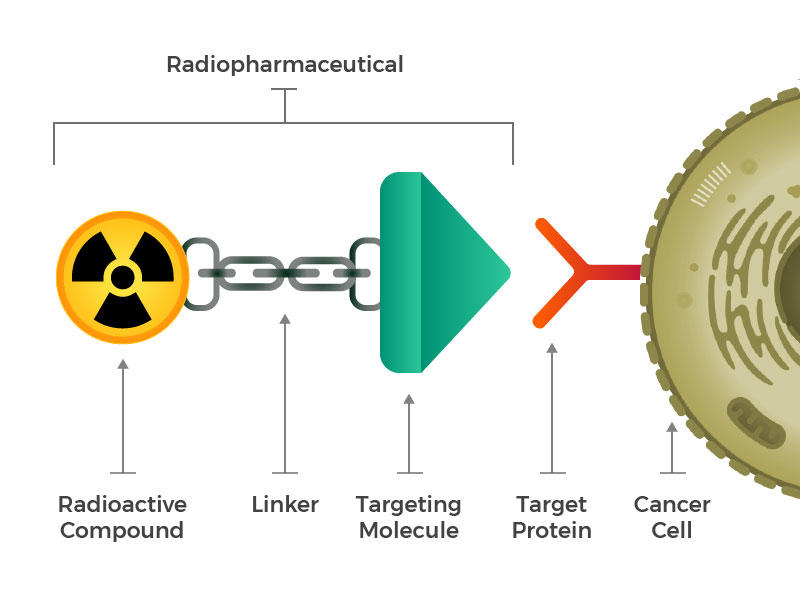
Dược chất phóng xạ chứa các phân tử phóng xạ, phân tử để nhắm mục tiêu và chất liên kết kết hợp (Nguồn: National Cancer Institute)
Hiện nay, các nhà nghiên cứu đã và đang phát triển các loại thuốc gọi là dược chất phóng xạ, cung cấp liệu pháp xạ trị trực tiếp và đặc biệt cho các tế bào ung thư. Vài năm gần đây đã chứng kiến sự bùng nổ của nghiên cứu và thử nghiệm lâm sàng các loại dược chất phóng xạ mới. Những nghiên cứu này cho thấy rằng xạ trị nhắm mục tiêu ở cấp độ tế bào có khả năng làm giảm nguy cơ tác dụng phụ ngắn hạn và dài hạn từ việc xạ trị, đồng thời cho phép tiêu diệt ngay cả những tế bào ung thư nhỏ nhất trên khắp cơ thể. Đây sẽ là phương pháp thay đổi xạ trị ung thư trong vòng 10 đến 15 năm tới.
Đưa bức xạ trực tiếp đến tế bào không phải là một phương pháp mới. Liệu pháp như vậy sử dụng iốt phóng xạ, đã được áp dụng để điều trị một số loại ung thư tuyến giáp từ những năm 1940. Iốt tích lũy tự nhiên trong tế bào tuyến giáp. Đồng vị phóng xạ của nguyên tố này có thể được tạo ra trong phòng thí nghiệm. Khi ăn vào (dưới dạng thuốc viên hoặc chất lỏng), nó sẽ tích tụ và tiêu diệt các tế bào ung thư còn sót lại sau phẫu thuật tuyến giáp. Ái lực tự nhiên tương tự sau đó đã được khai thác để phát triển các loại thuốc điều trị ung thư đã di căn đến xương, chẳng hạn như Ra-223 dichloride (Xofigo), được phê duyệt vào năm 2013 để điều trị ung thư tuyến tiền liệt di căn.
Khi các tế bào ung thư phát triển trong xương, chúng sẽ khiến các mô xương mà chúng xâm lấn bị phá vỡ. Sau đó, cơ thể cố gắng sửa chữa tổn thương này bằng cách thay thế xương đó – quá trình này được gọi là luân chuyển xương. Nguyên tố phóng xạ radi “giống một phân tử canxi, được tích hợp vào các khu vực của cơ thể nơi tốc độ luân chuyển xương cao nhất”, chẳng hạn như những khu vực mà ung thư đang phát triển. Radi sau đó có thể tiêu diệt các tế bào ung thư gần đó.

Những hợp chất phóng xạ này đều di chuyển đến các tế bào ung thư mà không cần bất kỳ sự trợ giúp nào. Các nhà nghiên cứu tự hỏi liệu có thể tạo ra các phân tử phóng xạ mới nhắm mục tiêu cụ thể vào các bệnh ung thư khác hay không. Họ đã hình dung ra các dược chất phóng xạ được thiết kế bao gồm ba khối xây dựng chính: phân tử phóng xạ, phân tử nhắm mục tiêu (nhận biết và bám đặc biệt vào các tế bào ung thư) và trình liên kết kết hợp cả hai. Các hợp chất như vậy có thể được tiêm, truyền, hít hoặc uống, sau đó đi vào máu. Ý tưởng liên kết phân tử nhắm mục tiêu ung thư với phân tử tiêu diệt tế bào ung thư cũng không phải là mới. Ví dụ: một số loại thuốc được gọi là liên hợp kháng thể-thuốc, trong đó kháng thể liên kết với các tế bào ung thư cụ thể có liên quan đến một loại thuốc độc được phê duyệt để điều trị ung thư. Những nỗ lực tạo ra những loại thuốc như vậy mới chỉ đạt được thành công hạn chế bởi việc đưa chất độc đến gần tế bào ung thư là chưa đủ. Các chất độc phải được đưa vào bên trong và tồn tại trong tế bào đủ lâu để gây ra tổn thương. Nhiều tế bào ung thư có hoặc phát triển các cơ chế để bơm độc tố ra ngoài ngay trước khi điều đó có thể xảy ra.

Dược chất phóng xạ cũng hoạt động tốt nhất khi có thể xâm nhập vào bên trong tế bào. Khi dược chất phóng xạ bám vào tế bào ung thư, hợp chất phóng xạ sẽ bị phân hủy một cách tự nhiên. Sự phân rã này giải phóng năng lượng làm tổn hại DNA của các tế bào lân cận. Và khi DNA của tế bào bị hư hỏng không thể sửa chữa được, tế bào đó sẽ chết. Các tế bào ung thư đặc biệt nhạy cảm với tổn thương DNA do bức xạ gây ra. Tùy thuộc vào loại hợp chất phóng xạ được sử dụng, năng lượng thu được có thể xuyên qua tế bào liên kết với dược chất phóng xạ cũng như khoảng 10 đến 30 tế bào xung quanh tế bào đó. Điều này làm tăng số lượng tế bào ung thư có thể bị tiêu diệt chỉ bằng một phân tử dược chất phóng xạ.
Vào giữa những năm 2010, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt hai loại dược chất phóng xạ nhắm vào các phân tử trên một số tế bào B để điều trị cho một số người mắc bệnh ung thư hạch không Hodgkin, một loại ung thư máu. Nhưng những loại thuốc này chưa bao giờ được áp dụng rộng rãi. Rất ít bác sĩ điều trị bệnh nhân ung thư hạch được đào tạo để sử dụng các loại hợp chất phóng xạ này. Và dược chất phóng xạ phải đối mặt với sự cạnh tranh từ các loại thuốc mới hơn, không chứa chất phóng xạ. Yếu tố thay đổi cuộc chơi trong lĩnh vực này đến vào năm 2018, khi FDA phê duyệt Lu177-dotatate (Lutathera) để điều trị một số khối u thần kinh nội tiết ung thư (NET) ảnh hưởng đến cơ thể, đường tiêu hóa. Điều này cho thấy các khối u rắn cũng có thể được nhắm mục tiêu với một loại dược chất phóng xạ được bào chế từ đầu. Trong trường hợp này, mục tiêu là các thụ thể hormone nhất định được tìm thấy rất nhiều trên bề mặt tế bào NET. Lu177-dotatate có khả năng làm chậm sự phát triển của NET tốt hơn bất kỳ loại thuốc nào được thử nghiệm trước đây.
Các nhà nghiên cứu hiện đang thiết kế và thử nghiệm dược chất phóng xạ cho nhiều loại bệnh ung thư như u ác tính, ung thư phổi, ung thư đại trực tràng và bệnh bạch cầu. Bất kỳ khối u nào có phân tử mục tiêu trên bề mặt tế bào và nguồn cung cấp máu tốt – đủ để cung cấp thuốc – đều có thể được điều trị bằng dược chất phóng xạ. Nhiều loại thuốc mới này là phiên bản được thiết kế lại của các hợp chất hiện được sử dụng để Xạ hình. Các xét nghiệm hình ảnh hạt nhân, chẳng hạn như chụp cắt lớp phát xạ positron (PET), đôi khi sử dụng các hợp chất phóng xạ yếu liên kết với các phân tử liên kết với các mục tiêu cụ thể trên bề mặt tế bào ung thư. Sau đó, các thiết bị chuyên dụng sẽ đưa ra hình ảnh ngay cả những tế bào ung thư nhỏ nhất, giúp đo lường sự lây lan của ung thư khắp cơ thể. Các nhà nghiên cứu hiện đã tái sử dụng các phân tử nhắm mục tiêu này để mang các hợp chất phóng xạ hoặc đồng vị mạnh hơn – những hợp chất có thể tiêu diệt tế bào ung thư thay vì chỉ giúp hình dung chúng.
Ung thư tuyến tiền liệt là nơi bệnh được thử nghiệm sớm cho việc tái sử dụng dược chất phóng xạ trong Xạ hình. Một loại protein có tên là PSMA được tìm thấy với số lượng lớn và hầu như chỉ có trên các tế bào tuyến tiền liệt. Bằng cách kết hợp phân tử liên kết với PSMA với một hợp chất phóng xạ được sử dụng trong chụp ảnh PET, các nhà khoa học đã có thể hình dung được các mảng ung thư tuyến tiền liệt nhỏ đến mức siêu nhỏ để có thể phát hiện được bằng hình ảnh thông thường. Một số phương pháp điều trị bằng dược chất phóng xạ PSMA hiện đang được thử nghiệm lâm sàng. Lợi thế lớn của việc có các dược chất phóng xạ dùng cho cả chẩn đoán hình ảnh và điều trị cùng một mục tiêu là hình ảnh sau đó có thể giúp bác sĩ xem trước liệu phương pháp điều trị có hiệu quả hay không. Ví dụ, nam giới phải chụp PET với phiên bản hình ảnh của hợp chất trước khi điều trị. Nếu hợp chất tạo ảnh tìm được đường đến các tế bào ung thư và được phát hiện trên máy PET thì các nhà nghiên cứu có thể cho rằng phương pháp điều trị bằng dược chất phóng xạ tương ứng sẽ đạt được mục tiêu.
Mặc dù dược chất phóng xạ cho thấy nhiều hứa hẹn trong các nghiên cứu ban đầu, nhưng cũng như trường hợp của các loại thuốc điều trị ung thư khác, chúng không có khả năng tự mình loại bỏ khối u. Lu177-dotatate giúp tăng hơn gấp đôi số người có khối u thần kinh nội tiết thu nhỏ lại sau khi điều trị, nhưng con số đó vẫn còn khiêm tốn: khoảng 17%, tăng từ 7% khi không dùng thuốc. Sử dụng dược chất phóng xạ kết hợp với các liệu pháp khác có thể là cách để thúc đẩy sự cải thiện điều trị. Một số nhà nghiên cứu hiện đang thử nghiệm dược chất phóng xạ kết hợp với chất nhạy cảm với bức xạ – loại thuốc khiến tế bào ung thư dễ bị tổn thương hơn trước bức xạ. Lu177-dotatate kết hợp với chất nhạy cảm với bức xạ có tên là triapine, giúp ngăn chặn tế bào sản xuất các hợp chất cần thiết để sửa chữa DNA sau tổn thương do bức xạ gây ra. Những loại thuốc này đã được phê duyệt để điều trị một số loại ung thư vú, buồng trứng và các bệnh ung thư khác, ngăn chặn quá trình tự sửa chữa DNA.
Các nhà nghiên cứu cũng đang kết hợp dược chất phóng xạ với liệu pháp miễn dịch để cố gắng nâng cao hiệu quả của những loại thuốc này. Nhiều khối u là khối u “lạnh” vì các tế bào miễn dịch không nhận ra chúng hoặc không hoạt động bình thường trong môi trường vi mô xung quanh khối u. Nhưng khi bức xạ tiêu diệt tế bào ung thư, protein và DNA từ các tế bào đó có thể tràn vào máu để các tế bào miễn dịch nhìn thấy, điều này có thể cho phép các tế bào miễn dịch nhận biết và tiêu diệt các tế bào ung thư khác trên khắp cơ thể. Liệu pháp xạ trị cũng có thể làm cho vi môi trường của khối u trở nên thân thiện hơn với các tế bào miễn dịch. Cùng với nhau, những tác động này có thể biến một khối u “lạnh” thành khối u “nóng”: khối u có nhiều tế bào miễn dịch và có thể đáp ứng với các loại thuốc trị liệu miễn dịch. Một số nghiên cứu đã thử sử dụng bức xạ bên ngoài để tạo ra loại phản ứng này. Nhưng dữ liệu cho thấy rằng liệu pháp miễn dịch hoạt động tốt hơn nếu mỗi khối u, mỗi khối di căn tiếp xúc với bức xạ. Vì vậy, liệu pháp dược chất phóng xạ có lợi thế ở đó, chạm tới mọi di căn. Thậm chí có thể kết hợp dược chất phóng xạ với xạ trị ngoài, miễn là lập kế hoạch điều trị cẩn thận đảm bảo liều bức xạ tổng thể an toàn.
Từ khóa: xạ trị; ung thư; dược chất phóng xạ
– CMD&DND –