Lịch sử của chuyên ngành điện quang can thiệp (Interventional Radiology – IR) không chỉ là sự tiến bộ về công cụ mà còn là cuộc cách mạng trong triết lý điều trị y khoa. Khởi điểm từ những năm cuối thế kỷ XIX với sự phát hiện ra tia X của Wilhelm Conrad Röntgen, y học chủ yếu sử dụng bức xạ cho mục đích quan sát các cấu trúc xương và chẩn đoán bệnh lý tĩnh. Tuy nhiên, bước ngoặt thực sự xảy ra vào năm 1963, khi Charles Dotter, người sau này được mệnh danh là “cha đẻ của điện quang can thiệp”, đã đưa ra ý tưởng mang tính đột phá tại Hội nghị Y khoa ở Tiệp Khắc. Ông đề xuất rằng các kỹ thuật chụp mạch không chỉ nên dừng lại ở việc chẩn đoán mà còn có thể trở thành phương tiện để điều trị trực tiếp các tổn thương mạch máu từ bên trong lòng mạch.
Sự kiện Charles Dotter thực hiện thủ thuật nong mạch vành bằng ống thông (catheter) đầu tiên đã mở ra một kỷ nguyên mới, khi các bác sĩ có thể tiếp cận mọi cơ quan trong cơ thể thông qua hệ thống mạch máu mà không cần thực hiện phẫu thuật mở xâm lấn. Với những đóng góp vĩ đại này, ông đã được đề cử giải Nobel Y học vào năm 1978, đánh dấu sự công nhận của cộng đồng khoa học quốc tế đối với tiềm năng to lớn của công nghệ bức xạ trong điều trị lâm sàng. Từ những năm 1950 đến nay, sự cải thiện không ngừng của các thiết bị chẩn đoán hình ảnh, đặc biệt là sự chuyển đổi từ hệ thống phim/bìa tăng quang cổ điển sang hệ thống tăng sáng truyền hình và sau đó là bộ thu nhận hình ảnh phẳng kỹ thuật số (Flat-panel detector), đã cho phép các thao tác can thiệp đạt đến độ chính xác ở cấp độ milimet.
Hiện nay, điện quang can thiệp được định nghĩa là một phân ngành chuyên sâu của chẩn đoán hình ảnh, thực hiện các thủ thuật xâm lấn tối thiểu dưới sự hướng dẫn của các phương tiện chẩn đoán hình ảnh như tia X (fluoroscopy), cắt lớp vi tính (CT), siêu âm và cộng hưởng từ (MRI). So với phẫu thuật truyền thống, các kỹ thuật can thiệp hướng dẫn bằng tia X mang lại những lợi thế vượt trội về mặt lâm sàng và kinh tế, bao gồm việc giảm đau đớn cho bệnh nhân, hạ thấp tỷ lệ nhiễm trùng, rút ngắn thời gian hồi phục và tối ưu hóa chi phí vận hành hệ thống y tế.
Table of Contents
Nguyên lý tạo ảnh bức xạ X trong can thiệp
Hệ thống chụp X-quang can thiệp vận hành dựa trên các nguyên lý tương tác phức tạp giữa bức xạ ion hóa và vật chất. Việc hiểu rõ các cơ chế này là điều kiện tiên quyết để tối ưu hóa chất lượng hình ảnh và đảm bảo an toàn bức xạ. Tia X được tạo ra bên trong bóng đèn phát tia thông qua quá trình bắn phá các electron năng lượng cao vào một bia kim loại (thường là Vonfram). Quá trình này diễn ra như sau: dòng điện chạy qua cuộn dây Vonfram tại cực âm (cathode) làm giải phóng các electron theo hiện tượng phát xạ nhiệt điện tử. Dưới tác động của hiệu điện thế cao (kVp), các electron này được gia tốc cực mạnh về phía cực dương (anode). Khi va chạm với bề mặt cực dương, động năng của electron được chuyển đổi thành nhiệt năng (khoảng 99%) và bức xạ X (khoảng 1%) dưới dạng bức xạ hãm (Bremsstrahlung) và bức xạ đặc trưng.
Trong can thiệp, việc kiểm soát các thông số phát tia là cực kỳ quan trọng:
- Hiệu điện thế (kVp): quyết định năng lượng và khả năng xuyên thấu của chùm tia X. kVp cao giúp tia X xuyên qua các vùng cơ thể dày nhưng làm giảm độ tương phản của hình ảnh.
- Cường độ dòng điện (mA) và thời gian phát tia (s): mAs quyết định số lượng photon X-quang tạo ra, ảnh hưởng trực tiếp đến độ đậm đặc của hình ảnh và liều bức xạ.
Khi chùm tia X đi xuyên qua cơ thể bệnh nhân, nó bị suy giảm cường độ do hai quá trình chính: hấp thụ hoàn toàn (hiệu ứng quang điện) và tán xạ (hiệu ứng Compton). Hiệu ứng quang điện đóng vai trò chủ đạo trong việc tạo ra độ tương phản hình ảnh, khi các mô có mật độ và số hiệu nguyên tử khác nhau sẽ hấp thụ tia X ở mức độ khác nhau. Sự suy giảm này tuân theo định luật lũy thừa. Đối với các cấu trúc mạch máu, do có mật độ tương đương với các mô mềm xung quanh, khiến chúng gần như “vô hình” trên hình ảnh X-quang thông thường. Để giải quyết vấn đề này, các chất cản quang dựa trên i-ốt được đưa vào mạch. I-ốt có số hiệu nguyên tử cao, làm tăng đột biến sự hấp thụ tia X tại vị trí mạch máu, tạo ra sự chênh lệch rõ rệt về mật độ quang học trên hình ảnh thu nhận.
Hệ thống công nghệ ghi nhận hình ảnh và Xử lý số hóa
Sự tiến bộ của kỹ thuật can thiệp gắn liền với khả năng chuyển đổi dữ liệu tia X thành hình ảnh kỹ thuật số chất lượng cao trong thời gian thực. Trong nhiều thập kỷ, bộ thu nhận và khuếch đại hình ảnh (Image Intensifier – II) là thiết bị tiêu chuẩn. Tuy nhiên, hệ thống này gặp phải nhiều hạn chế như biến dạng hình ảnh kiểu “gối” hoặc “thùng”, dải động hẹp và kích thước cồng kềnh. Sự ra đời của bộ thu nhận hình ảnh phẳng số hóa (Flat-panel detector – FPD) đã khắc phục hoàn toàn các nhược điểm này. Detector phẳng sử dụng các tấm bán dẫn vô định hình (Amorphous Silicon hoặc Amorphous Selenium) để chuyển đổi trực tiếp hoặc gián tiếp các photon tia X thành tín hiệu điện tích.
Lợi ích của FPD trong can thiệp bao gồm:
- Độ phân giải không gian cao: cho phép quan sát các dụng cụ can thiệp siêu nhỏ như vi ống thông (microcatheter) hay dây dẫn (guidewire).
- Dải động rộng: hiển thị tốt cả các vùng có mật độ cao (xương, dụng cụ kim loại) và vùng mật độ thấp (phổi, mô mềm) trên cùng một khung hình mà không bị cháy sáng hay mất chi tiết.
- Khả năng tái tạo 3D: đầu dò phẳng là thành phần cốt lõi để thực hiện kỹ thuật chụp cắt lớp vi tính bằng chùm tia hình nón (Cone-beam CT – CBCT) ngay trong phòng can thiệp.
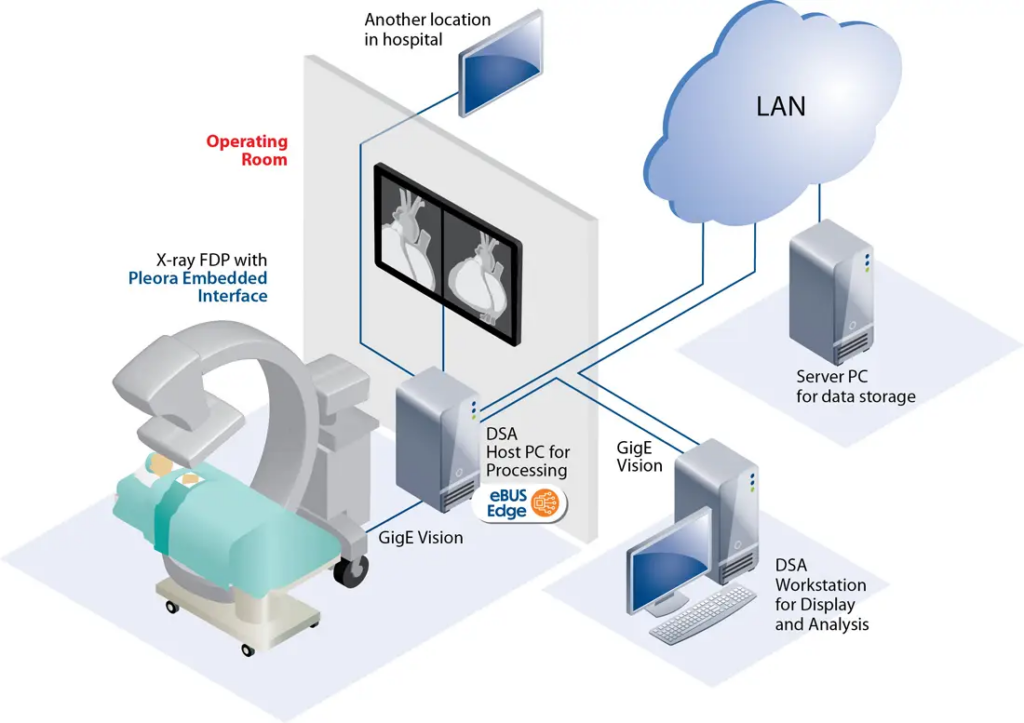
Công nghệ chụp mạch số hóa xóa nền (DSA)
DSA là một trong những ứng dụng tinh vi nhất của xử lý ảnh kỹ thuật số trong y học. Nguyên lý cốt lõi là kỹ thuật “subtraction” (phép trừ) để loại bỏ các cấu trúc giải phẫu không cần thiết và chỉ giữ lại hình ảnh dòng máu. Quy trình kỹ thuật của DSA diễn ra theo các pha:
- Pha mặt nạ (Mask phase): máy thu nhận hình ảnh vùng giải phẫu đích khi chưa có thuốc cản quang. Hình ảnh này chứa thông tin về xương, răng, vôi hóa và các dụng cụ cấy ghép kim loại.
- Pha tiêm thuốc (Contrast phase): thuốc cản quang được bơm vào mạch máu và máy chụp liên tục một chuỗi hình ảnh phản ánh sự di chuyển của dòng thuốc qua các thì động mạch, mao mạch và tĩnh mạch.
- Pha xóa nền: máy tính thực hiện phép trừ giá trị thang xám của từng pixel giữa ảnh mặt nạ và ảnh cản quang. Kết quả là các cấu trúc tĩnh bị triệt tiêu hoàn toàn, chỉ còn lại sự hiện diện của thuốc cản quang hiện lên với độ tương phản cực cao.
Bảng so sánh các đặc tính kỹ thuật giữa hệ thống DSA và CT Angiography (CTA)
| Đặc tính | Digital Subtraction Angiography (DSA) | CT Angiography (CTA) |
| Bản chất kỹ thuật | Chụp mạch chiếu tia X thời gian thực | Chụp cắt lớp vi tính tái tạo 3D |
| Tính xâm lấn | Cao (cần đặt catheter vào động mạch) | Thấp (tiêm thuốc tĩnh mạch) |
| Độ phân giải thời gian | Cực cao (quan sát dòng chảy trực tiếp) | Trung bình |
| Khả năng can thiệp | Kết hợp chẩn đoán và điều trị tức thì | Chỉ phục vụ chẩn đoán và lập kế hoạch |
| Liều bức xạ | Phụ thuộc vào thời gian chiếu (thường cao) | Theo giao thức chụp (tương đối cao) |
| Lượng thuốc cản quang | Ít hơn do tiêm chọn lọc | Nhiều hơn do tiêm tĩnh mạch ngoại biên |
Phòng can thiệp tim mạch hay điện quang can thiệp là một môi trường tích hợp cao độ giữa phòng mổ vô khuẩn và phòng máy X-quang công nghệ cao. Hệ thống C-arm là cấu trúc khung cơ khí hình chữ C chứa bóng đèn phát tia X ở một đầu và bộ thu nhận hình ảnh ở đầu kia. Thiết kế này cho phép hệ thống quay quanh bệnh nhân theo nhiều trục (cranial/caudal, LAO/RAO), giúp bác sĩ quan sát tổn thương từ mọi góc độ mà không cần thay đổi tư thế người bệnh. Bàn bệnh nhân can thiệp thường được làm bằng sợi carbon – một vật liệu có độ bền cao nhưng độ hấp thụ tia X cực thấp, giúp giảm thiểu nhiễu ảnh và liều bức xạ.
Mỗi thủ thuật can thiệp đều bắt đầu bằng quy trình “Time-out” để xác nhận đúng bệnh nhân, đúng vị trí can thiệp và đúng thủ thuật. Do các dụng cụ (catheter, stent) được đưa trực tiếp vào hệ thống mạch máu, môi trường trong phòng can thiệp phải tuân thủ nghiêm ngặt các tiêu chuẩn vô khuẩn tương đương với phòng mổ ngoại khoa. Nhân viên y tế thực hiện thủ thuật phải rửa tay ngoại khoa, mặc áo mổ vô khuẩn và đeo găng tay vô trùng. Vùng chọc mạch (thường là động mạch đùi hoặc động mạch quay) được sát trùng kỹ lưỡng và phủ khăn trải vô khuẩn.
Can thiệp tim mạch và mạch máu ngoại biên
Can thiệp mạch vành qua da (PCI) là ứng dụng phổ biến nhất, cho phép điều trị các trường hợp hẹp động mạch vành gây nhồi máu cơ tim. Thông qua sự hướng dẫn của tia X, bác sĩ đưa một quả bóng nhỏ vào vị trí tắc nghẽn, bơm căng để mở rộng lòng mạch và đặt giá đỡ (stent) để duy trì sự thông thoáng lâu dài. Đối với các bệnh lý mạch máu ngoại biên, can thiệp giúp tái thông các động mạch chi bị tắc nghẽn, điều trị túi phình động mạch chủ ngực và bụng thông qua đặt giá đỡ nội mạch (EVAR).
Can thiệp thần kinh và đột quỵ não
Trong lĩnh vực thần kinh, kỹ thuật can thiệp lấy huyết khối bằng dụng cụ cơ học đã thay đổi hoàn toàn tiên lượng của bệnh nhân đột quỵ não cấp. Các nghiên cứu lâm sàng tại Việt Nam, cụ thể là tại Bệnh viện Nhân dân 115, cho thấy tỷ lệ tái thông mạch máu não đạt mức ấn tượng 96,2%. Việc mở rộng cửa sổ điều trị lên đến 24 giờ cho phép cứu sống nhiều bệnh nhân có “lõi” hoại tử nhỏ nhưng vùng nhu mô não có nguy cơ (penumbra) lớn. Ngoài ra, nút túi phình mạch não bằng vòng xoắn kim loại (Coil) dưới hướng dẫn của DSA là phương pháp ít xâm lấn giúp ngăn ngừa tử vong do xuất huyết dưới nhện.
Điện quang can thiệp ung thư (Interventional Oncology)
Đây là một trong những lĩnh vực phát triển nhanh nhất, cung cấp các giải pháp điều trị tại chỗ cho khối u gan, thận, phổi và xương:
- Nút mạch hóa chất (TACE): thường dùng cho ung thư gan. Thuốc hóa chất trộn với chất cản quang Lipiodol được bơm trực tiếp vào động mạch nuôi khối u, sau đó gây tắc mạch để tập trung nồng độ thuốc cao tại u và cắt đứt nguồn dinh dưỡng của khối u.
- Đốt u bằng nhiệt (Ablation): sử dụng năng lượng sóng cao tần (RFA) hoặc vi sóng (MWA) để tạo ra nhiệt độ cao tiêu diệt tế bào ung thư thông qua một cây kim xuyên qua da dưới sự hướng dẫn của CT hoặc siêu âm.
Bảng tổng hợp các chỉ số thành công và biến chứng của một số thủ thuật IR phổ biến
| Thủ thuật | Tỷ lệ thành công kỹ thuật | Tỷ lệ biến chứng nghiêm trọng | Thời gian hồi phục trung bình |
| Lấy huyết khối đột quỵ | 96.2% (TICI 2b/3) | 5% (Chảy máu não triệu chứng) 23 | 3 – 7 ngày |
| Đặt Stent mạch vành | > 95% | < 2% | 1 – 2 ngày |
| Sinh thiết dưới hướng dẫn IR | > 90% | < 1% | Vài giờ – 1 ngày |
| Nút mạch u xơ tử cung | 85 – 90% | < 3% | 2 – 5 ngày |
Để tuân thủ nguyên tắc ALARA, các bác sĩ can thiệp cần áp dụng các kỹ thuật sau:
- Chiếu xung (Pulsed Fluoroscopy): thay vì phát tia liên tục, máy phát tia theo các xung ngắn. Giảm tốc độ xung từ 15 khung hình/giây xuống 7.5 khung hình/giây có thể cắt giảm gần 50% liều bức xạ mà không làm ảnh hưởng nhiều đến thao tác can thiệp.
- Khu trú chùm tia (Collimation): thu hẹp chùm tia X vào đúng vùng quan tâm giúp giảm thể tích mô bị chiếu xạ, đồng thời cải thiện chất lượng hình ảnh do giảm bức xạ tán xạ.
- Tránh chiếu lặp tại một vị trí da: thay đổi góc chiếu của hệ thống C-arm để phân tán liều da, ngăn ngừa tổn thương da (đỏ da, loét da) khi CAK vượt quá ngưỡng 3 Gy.
Dữ liệu về liều bức xạ điển hình cho một số thủ thuật can thiệp phổ biến
| Thủ thuật | Liều hiệu dụng trung bình (mSv) | Tương đương số lần chụp X-quang phổi |
| Chụp mạch vành chẩn đoán | 3.1 | 155 |
| Can thiệp mạch vành (PTCA/Stent) | 15.1 | 755 |
| Chụp mạch não | 3.0 | 150 |
| Can thiệp nút mạch gan (TACE) | 20 – 50 | 1000 – 2500 |
| Tạo thông cửa chủ (TIPS) | 53.6 | 2680 |
| Nút mạch u xơ tử cung (UFE) | 77.5 | 3875 |
Mặc dù chi phí trang thiết bị và dụng cụ tiêu hao trong IR là rất lớn, nhưng khi phân tích tổng chi phí điều trị và chất lượng cuộc sống (QALY), IR thường tỏ ra ưu việt hơn phẫu thuật. Việc rút ngắn thời gian nằm viện từ 7-10 ngày xuống còn 1-2 ngày giúp bệnh viện tăng tỷ lệ quay vòng giường bệnh và giảm gánh nặng chi phí cho người bệnh và hệ thống bảo hiểm y tế. Ví dụ, tại các nước đang phát triển, việc triển khai IR giúp giải quyết các bệnh lý mạch máu mà không cần đầu tư quá nhiều vào hạ tầng phòng mổ phức tạp và nhân lực gây mê hồi sức chuyên sâu.
Theo các báo cáo nghiên cứu thị trường mới nhất từ Global Market Insights và Mordor Intelligence, quy mô thị trường điện quang can thiệp toàn cầu đạt khoảng 30.9 tỷ USD vào năm 2025 và dự kiến sẽ tăng trưởng với tốc độ CAGR từ 5.2% đến 7.2% để đạt mức trên 55 tỷ USD vào năm 2035.
| Khu vực | Thị phần 2025 (%) | Đặc điểm thị trường |
| Bắc Mỹ | 43.1% | Cơ sở hạ tầng tiên tiến, tỷ lệ áp dụng công nghệ mới cao nhất. |
| Châu Âu | 25 – 30% | Quy định nghiêm ngặt về an toàn bức xạ, tập trung vào hiệu quả chi phí. |
| Châu Á – Thái Bình Dương | Tăng trưởng nhanh nhất | Trung Quốc và Ấn Độ dẫn đầu do đầu tư mạnh vào hệ thống y tế công cộng. |
Cuộc cách mạng Trí tuệ nhân tạo (AI) và Robot trong Điện quang Can thiệp
Một trong những ứng dụng đột phá nhất của AI là khả năng tái tạo hình ảnh 3D-DSA chất lượng cao từ các dữ liệu chiếu X-quang cực thưa. Các nghiên cứu năm 2024 chỉ ra rằng thuật toán AI có thể giúp thực hiện tái tạo 3D chỉ với 1/16 lượng dữ liệu thông thường, giúp giảm liều bức xạ cho bệnh nhân xuống tới 94% mà không làm mất đi các chi tiết chẩn đoán quan trọng. Ngoài ra, các hệ thống “Virtual Collimation” (khu trú ảo) cho phép bác sĩ điều chỉnh cửa sổ phát tia trên màn hình mà không cần phát tia thật để kiểm tra, giúp loại bỏ các phơi nhiễm không cần thiết.
Các hệ thống Robot như Corindus hay Robocath cho phép bác sĩ điều khiển dây dẫn và ống thông từ xa thông qua một cần điều khiển (joystick). Điều này mang lại hai lợi ích lớn:
- Độ chính xác cơ học: Robot có thể thực hiện các chuyển động tiến/lùi và xoay với độ mịn ở mức dưới milimet, vượt xa khả năng của bàn tay người.
- Loại bỏ liều bức xạ cho bác sĩ: Bác sĩ ngồi trong buồng điều khiển có tấm chắn chì bảo vệ hoàn hảo, không cần mặc áo chì nặng nề trong nhiều giờ, giúp giảm thiểu các bệnh lý về cột sống.
Công nghệ Fusion Imaging cho phép chồng hình ảnh CT hoặc MRI đã được dựng 3D từ trước lên hình ảnh chiếu X-quang trực tiếp. AI sẽ thực hiện việc khớp (registration) các khối dữ liệu này trong thời gian thực, giúp bác sĩ nhìn thấy các cấu trúc mô mềm hoặc khối u vốn không hiển thị rõ trên tia X. Điều này cực kỳ hữu ích trong các thủ thuật phức tạp như chọc dò tĩnh mạch cửa xuyên gan (TIPS) hay điều trị các túi phình mạch não có cấu trúc giải phẫu khó.
Việt Nam đã có những bước tiến dài để bắt kịp các nước tiên tiến trong lĩnh vực điện quang can thiệp. Các bệnh viện tuyến trung ương như Bệnh viện Bạch Mai, Bệnh viện Chợ Rẫy, Bệnh viện Trung ương Quân đội 108 và Bệnh viện Nhân dân 115 hiện nay đều sở hữu các phòng can thiệp Hybrid hiện đại. Chuyên ngành Điện quang can thiệp tại Việt Nam đã triển khai thành công các kỹ thuật khó như lấy huyết khối cơ học trong đột quỵ não, nút mạch điều trị ung thư gan bằng các hạt vi cầu phóng xạ, và can thiệp điều trị các dị dạng mạch máu bẩm sinh phức tạp.
Từ khóa: điện quang;
– CMD –