Glioblastoma là một loại khối u ác tính xâm lấn và chiếm khoảng 15 % các ca u não hiện nay. Ngay cả khi được kiểm soát sớm, khả năng sản sinh trở lại của các khối u này vẫn rất cao. Phẫu thuật và xạ trị có thể kéo dài thời gian sống của bệnh nhân thêm vài tháng, nhưng ung thư não thường cho bệnh nhân sống được trong vòng một đến hai năm sau khi phát hiện và chỉ khoảng dưới 5% bệnh nhân sống sót tới 5 năm. Giống như u nguyên bào thần kinh đệm, ung thư não là thách thức đối với việc điều trị do tính chất nhạy cảm của mô não bình thường đối với phẫu thuật và xạ trị. Tuy nhiên, điều này sẽ sớm thay đổi nhờ vào các liệu pháp mới có thể thực hiện được bằng máy gia tốc tạo ra các nguồn nơtron cường độ cao.
Các nhà vật lý hạt nhân tại IAEA đang phát triển các ứng dụng máy gia tốc để sản xuất neutron và dược chất phóng xạ trong y học. Việc sử dụng công nghệ hạt nhân trong liệu pháp điều trị ung thư cụ thể là liệu pháp bắt neutron boron (BNCT) có nhiều tiềm năng và hiệu quả đặc biệt với ung thư não. Việc bắn neutron vào các nguyên tử boron trong một số bệnh ung thư não, đầu và cổ có thể làm tang khả năng sống của bệnh nhân.
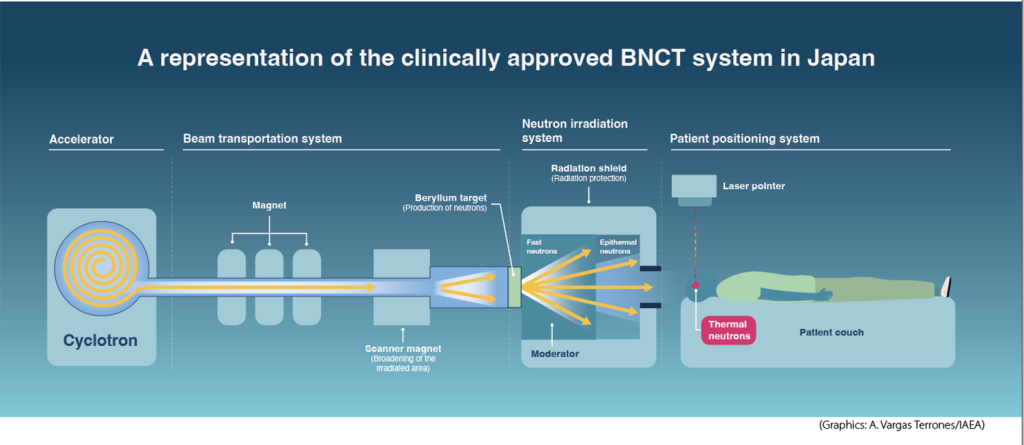
BNCT sử dụng khả năng tác động của neutron và dựa vào việc khoanh vùng tổn thương khối u, đặc biệt là khai thác khả năng của neutron với các đồng vị boron-10. Boron-10 không phóng xạ và có khả năng bắt neutron tốt. Trong phản ứng hạt nhân cục bộ, boron vỡ thành hai mảnh năng lượng. Bằng cách tiêm cho bệnh nhân các loại thuốc đặc biệt gắn boron-10 đến các vị trí khối u, các nhà khoa học được coi là đặt một “con mắt lớn” đối với bệnh ung thư. BNCT không phổ biến rộng rãi, nhưng điều đó sẽ được thay đổi trong tương lai, khi mà công nghệ hỗ trợ ngày một phát triển cùng với các kỹ thuật hạt nhân trở thành phổ biến. Năm 2020, hai cơ sở BNCT được đưa vào hoạt động và bắt đầu điều trị lâm sàng tại Koriyama và Osaka ở Nhật Bản. Trong cùng năm đó, IAEA và Đại học Okayama của Nhật Bản đã tăng cường hợp tác về BNCT thông qua các sự kiện, trao đổi kiến thức và thông tin cũng như phát triển cơ sở dữ liệu cơ sở BNCT. Năm 2001, IAEA đưa ra một báo cáo kỹ thuật về BNCT, báo cáo này đã trở thành tài liệu tham khảo cho lĩnh vực này. Vào thời điểm đó, nguồn neutron duy nhất là từ các lò phản ứng nghiên cứu. Kể từ đó, một thế hệ mới tạo các nguồn neutron dựa trên máy gia tốc nhỏ gọn đã được phát triển, có thể lắp đặt trực tiếp tại các phòng khám. Điều này đã dẫn đến sự hồi sinh lớn về BNCT. Các dự án BNCT đang được phát triển mới ở Argentina, Trung Quốc, Phần Lan và Hàn Quốc.
Nguyên lý của phương pháp xạ trị BNCT
BNCT là phương pháp điều trị ung thư dựa trên cơ chế phản ứng của bức xạ neutron nhiệt và hạt nhân của đồng vị boron (10B) có trong hợp chất đã được đưa chọn lọc vào trong các khối u. Bức xạ neutron nhiệt gây ra phản ứng hạt nhân, biến đổi hạt nhân đồng vị bền 10B thành hạt nhân ở trạng thái kích thích và sau đó phân rã tạo thành các sản phẩm phân rã gồm hạt α (He4, năng lượng 1,47 MeV), hạt nhân của đồng vị bền Li7 (năng lượng 0,84 MeV) và lượng tử gamma (γ, năng lượng 0,477 MeV) theo sơ đồ phản ứng:
10B + nth→ [10B]* → α + 7Li + γ
Hạt α và Li7 tạo thành sau phân rã mang năng lượng và có quãng chạy trung bình rất ngắn (cỡ µm) tương đương với đường kính của một nhân tế bào nên tất cả năng lượng của chúng đều được giải phóng bên trong tế bào khối u và nhờ đó tế bào khối u bị tiêu diệt với xác suất cao trong khi không gây ảnh hưởng đến các tế bào lành xung quanh. Chính bởi các hạt mang năng lượng cao nhưng lại tác dụng trên khoảng cách rất ngắn do đó chúng chỉ tác động trong phạm vi từng tế bào riêng lẻ và đó lại là những tế bào mang bệnh do hợp chất điều chế chứa 10B được đưa vào trước đó có đặc tính chọn lọc chỉ tập trung tại vị trí khối u.
Trong phương pháp BNCT, đồng vị 10B được sử dụng do có tiết diện hấp thụ neutron nhiệt cao (σ = 3.837 barn), tức là có khả năng dễ dàng bắt neutron nhiệt để gây ra phản ứng; bức xạ neutron nhiệt lại ít ảnh hưởng đến các tế bào bình thường do tiết diện phản ứng của các nguyên tố 1H; 12C; 14N và 16O có trong mô tế bào rất thấp, chỉ tương ứng là 0,332 barn; 0,0034 barn; 1,81 barn và 0,00018 barn trong khi so với tiết diện phản ứng của 10B là 3.837 barn. Bên cạnh đó, có thể thấy, phản ứng hấp thụ neutron nhiệt phụ thuộc vào thông lượng neutron nhiệt và nồng độ của hạt nhân 10B trong tế bào; thông lượng neutron càng lớn hay nồng độ 10B càng cao thì xác suất phản ứng sinh ra càng nhiều dẫn đến khả năng tiêu diệt tế bào càng cao.
Cuộc cách mạng Cyclotron
Việc xác định tính khả thi của BNCT trên một bệnh nhân đòi hỏi phải tiêm một hợp chất boron được đánh dấu phóng xạ bằng Flo-18 (18F), được sản xuất từ Cyclotron, sau đó xạ hình bằng kỹ thuật y học hạt nhân PET/CT. Hợp chất được dán nhãn 18F được gọi là 4-borono-2-18F-fluoro-phenylalanine, hoặc FBPA. FBPA rất quan trọng vì nó xác nhận khối u đã hấp thụ hợp chất chứa boron và sẵn sàng cho BNCT hay chưa. Không có nó, liệu pháp có thể không hiệu quả. Khi BNCT trở nên phổ biến rộng rãi hơn, thế giới sẽ cần các Cyclotron để đáp ứng nhu cầu FBPA. Cyclotron là loại máy gia tốc hạt tạo ra các đồng vị phóng xạ được sử dụng trong y học hạt nhân bằng cách bắn chùm tia vào các đồng vị ổn định. Sự tương tác đó dẫn đến phản ứng hạt nhân tạo ra các đồng vị phóng xạ tồn tại trong thời gian ngắn. Bởi các đồng vị phóng xạ này phân rã nhanh, nên chúng cần được sản xuất gần hoặc trên địa điểm xử lý và sử dụng ngay.

Hệ thống máy gia tốc nuBeam xạ trị BNCT của IBA/Neutron Therapeutics (Mỹ)
Mặc dù số lượng lò phản ứng nghiên cứu được sử dụng trong sản xuất đồng vị phóng xạ khá ổn định, nhưng với khả năng linh hoạt và giá cả hợp lý, các cyclotron mới đang gia tăng trên toàn thế giới. Nhiều đồng vị phóng xạ tồn tại trong thời gian ngắn được sử dụng cho bệnh nhân có thể được sản xuất bởi Cyclotron trong bệnh viện và đó là một lợi thế lớn của công nghệ này. Dược phẩm phóng xạ fluorodeoxyglucose dựa trên 18F có thể được sản xuất bằng cyclotron. Chất đánh dấu phóng xạ đó được sử dụng trong khoảng 95% quy trình PET/CT và do đó rất quan trọng trong chẩn đoán hình ảnh thần kinh và ung thư. Dược phẩm phóng xạ khác là gali-68 (68Ga), là thành phần chính của một số dược phẩm trị liệu – một loại dược phẩm phóng xạ cho cả chẩn đoán và điều trị thông qua việc giải phóng bức xạ. Dược phẩm phóng xạ như vậy đóng vai trò quan trọng trong chẩn đoán và theo dõi bệnh ung thư, đặc biệt trong việc giải quyết bệnh ung thư tuyến tiền liệt. Tuy nhiên, việc sản xuất 68Ga cũng có những thách thức nhất định. Hiện nay, phương pháp phổ biến nhất để sản xuất 68Ga là sử dụng hệ thống không có máy gia tốc gọi là máy phát, nhưng máy phát không thể sản xuất đủ để đáp ứng nhu cầu ngày một tăng. Cyclotron cung cấp một phương tiện thay thế hiệu quả cho sản xuất trực tiếp và đã mở rộng đáng kể khả năng này trong những năm trở lại đây. IAEA hiện đang điều phối một dự án nghiên cứu để hỗ trợ trao đổi chuyên môn quốc tế trong việc sản xuất 68Ga dựa trên cyclotron và vào năm 2019 đã phát hành Ấn phẩm về Sản xuất Cyclotron Gallium-68.
Từ khóa: PET/CT; xạ hình; ung thư não; 68Ga; xạ trị; BNCT;
– CMD&DND –