Nhóm các nhà khoa học do Tiến sĩ Kei-ichi Takata dẫn đầu từ Trung tâm Gen (CGI) thuộc Viện Khoa học Cơ bản (IBS), đã phát hiện ra một loại cơ chế sửa chữa DNA mới mà các tế bào ung thư sử dụng để phục hồi thế hệ tiếp theo sau xạ trị ung thư. Công trình này được công bố trên Tạp chí Nucleic Acids Research ngày 20 tháng 2 năm 2023.
Liệu pháp bức xạ ion hóa (IR) hay xạ trị được sử dụng phổ biến trong điều trị ung thư và được cho là có thể tiêu diệt các tế bào ung thư thông qua cơ chế phá vỡ DNA. Loại xạ trị mới nhất khai thác bức xạ được tạo ra bởi máy gia tốc hạt, bao gồm các hạt nặng tích điện như ion carbon. Máy gia tốc hạt tăng tốc các ion carbon lên khoảng 70% tốc độ ánh sáng, va chạm và phá hủy DNA của tế bào ung thư. Các ion này có độ truyền năng lượng tuyến tính (LET) cao và giải phóng phần lớn năng lượng của chúng trong một phạm vi ngắn, được gọi là đỉnh Bragg. Liệu pháp xạ trị ung thư thế hệ tiếp theo hoạt động bằng cách tập trung đỉnh Bragg vào khối u, điều này mang tới điểm lợi là giảm thiểu tổn thương cho các mô bình thường xung quanh so với bức xạ LET thấp thường được sử dụng như tia gamma hoặc tia X.
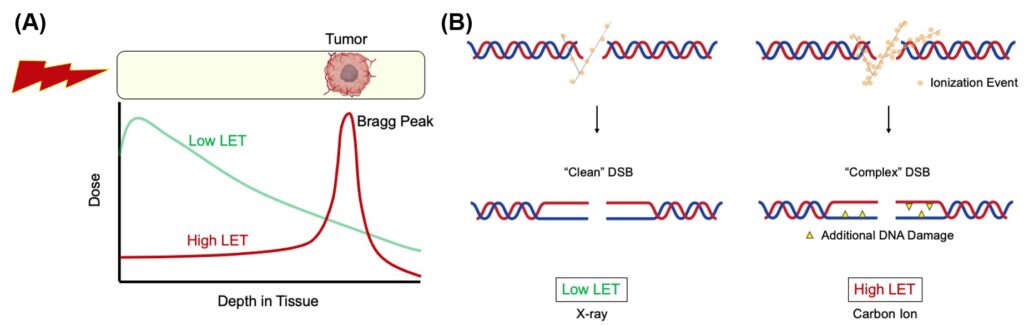
(A) Phân bố liều theo chiều sâu của tia X LET thấp và đường cong Bragg đơn năng đối với các ion carbon LET cao. (B) Các ion cacbon tạo ra các DSB “phức tạp” hơn và tia X tạo ra các DSB tương đối “sạch” (Nguồn: Nghiên cứu Axit Nucleic (2023))
Hiện chỉ có một số cơ sở y tế trên thế giới có khả năng cung cấp liệu pháp bức xạ thế hệ tiếp theo này, mặc dù nhiều cơ sở y tế hy vọng sẽ được triển khai trong tương lai. Các tổn thương DNA được tạo ra do bắn phá ion nặng (bức xạ LET cao) “phức tạp” hơn so với các tổn thương do xạ trị truyền thống (bức xạ LET thấp). Liệu pháp xạ trị này có thể làm tăng thêm những tổn thương DNA như apurinic/apyrimidinic (AP) và thymine glycol (Tg) ở gần các vị trí đứt gãy sợi đôi (DSB) của tế bào, khó sửa chữa hơn nhiều so với tổn thương DNA thông thường. Kết quả là, liệu pháp tiên tiến gây độc tế bào trên mỗi đơn vị liều nhiều hơn so với bức xạ LET thấp.
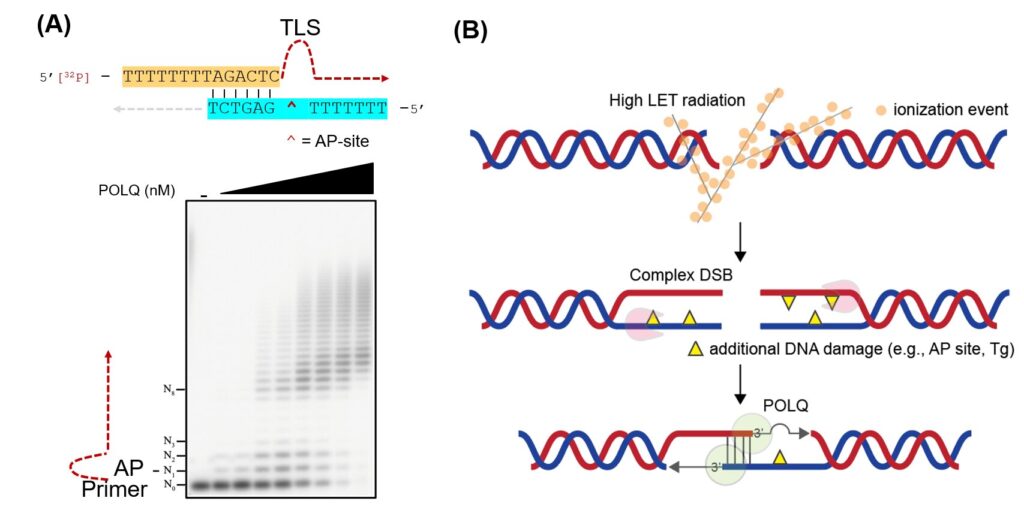
(A) POLQ có thể loại bỏ hai đuôi DNA chuỗi đơn bằng cách sử dụng trình tự tương đồng ngắn và có thể tránh được tổn thương DNA. (B) Mô hình sửa chữa qua trung gian POLQ sau bức xạ LET cao. POLQ thúc đẩy sự hình thành khớp thần kinh của hai đuôi DNA chuỗi đơn 3′ được cắt bỏ và vượt qua hiệu quả các tổn thương DNA nằm trên đuôi (Nguồn: Nghiên cứu Axit Nucleic (2023))
Điều đó làm cho liệu pháp xạ trị thế hệ tiếp này theo trở thành vũ khí mạnh mẽ chống lại các tế bào ung thư. Tuy nhiên, người ta vẫn chưa nghiên cứu đầy đủ về cách xử lý các tổn thương do LET cao này trong tế bào động vật có vú, vì tổn thương DNA do bắn phá ion nặng là một quá trình hiếm khi xảy ra trong tự nhiên (khả năng xảy ra cao hơn ở ngoài vũ trụ). Việc tìm ra cơ chế sửa chữa DSB phức tạp là một mối quan tâm nghiên cứu hấp dẫn vì việc ngăn chặn cơ chế sửa chữa của tế bào ung thư có thể cho phép liệu pháp xạ trị mới thậm chí còn hiệu quả hơn. Để tiến hành nghiên cứu, nhóm IBS đã đến bệnh viện QST ở Nhật Bản để sử dụng máy synchrotron có tên HIMAC (Máy gia tốc y tế ion nặng ở Chiba), có khả năng tạo ra bức xạ LET cao. Một synchrotron tương tự đã được lắp đặt tại Đại học Yonsei và một chiếc khác dự kiến sẽ được lắp đặt tại Bệnh viện Đại học Quốc gia Seoul ở Kijang vào năm 2027. Nhóm nghiên cứu của Tiến sĩ Takata dự định giúp thiết lập một chương trình nghiên cứu cơ bản sử dụng các synchrotron này ở Hàn Quốc để cải thiện ion nặng. điều trị ở bệnh nhân ung thư.
Nhóm nghiên cứu của Tiến sĩ Takata đã phát hiện ra rằng DNA polymerase θ (POLQ) là một yếu tố quan trọng khi sửa chữa các DSB phức tạp, chẳng hạn như các DSB gây ra bởi sự bắn phá ion nặng. POLQ là một DNA polymerase duy nhất có khả năng thực hiện quá trình nối cuối qua trung gian vi mô cũng như tổng hợp dịch mã (TLS) qua vị trí abasic (AP) và thymine glycol (Tg). Hoạt động TLS này được phát hiện là yếu tố có ý nghĩa sinh học cho phép sửa chữa DSB phức tạp. Sung Yubin, một trong những nhà nghiên cứu trong nhóm, giải thích: “Chúng tôi đã cung cấp bằng chứng cho thấy hoạt động TLS của POLQ đóng vai trò quan trọng trong việc sửa chữa các LET-DSB cao. Chúng tôi nhận thấy rằng POLQ ủ và mở rộng các chất nền bắt chước DSB phức tạp một cách hiệu quả.” Các nhà nghiên cứu cũng phát hiện ra rằng việc ngăn chặn sự biểu hiện của POLQ trong tế bào ung thư làm tăng đáng kể khả năng dễ bị tổn thương của chúng đối với phương pháp điều trị bằng kỹ thuật xạ trị mới.
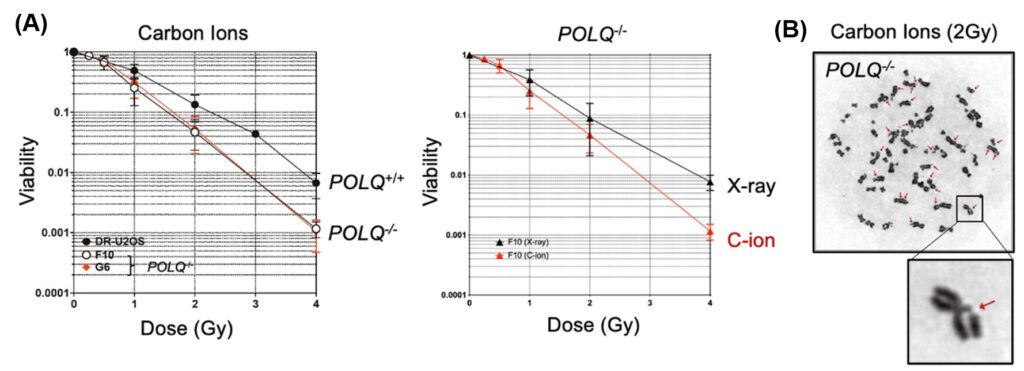
(A) Ảnh hưởng của việc xóa POLQ đến tỷ lệ sống sót của tế bào sau khi chiếu xạ ion carbon hoặc tia X. (B) Việc xóa POLQ làm tăng sự đứt gãy nhiễm sắc thể sau khi chiếu xạ ion carbon (Nguồn: Nghiên cứu Axit Nucleic (2023))
Ông Yi Geunil, một trong những nhà nghiên cứu trong nhóm giải thích: “Chúng tôi đã chứng minh rằng sự gián đoạn di truyền của POLQ dẫn đến sự gia tăng các đứt gãy nhiễm sắc thể và tăng cường độ nhạy cảm của tế bào sau khi điều trị bằng bức xạ LET cao”. Nhóm nghiên cứu đã sử dụng các kỹ thuật sinh hóa và Truyền năng lượng cộng hưởng huỳnh quang (FRET) để phát hiện ra rằng protein POLQ có thể sửa chữa hiệu quả các phân tử DNA tổng hợp bắt chước DSB phức tạp. Điều này có nghĩa là POLQ có thể là một mục tiêu thuốc mới tiềm năng nhằm tăng tính dễ bị tổn thương của tế bào ung thư trước những tổn thương do bức xạ phức tạp gây ra. Hệ thống xét nghiệm FRET đơn phân tử để theo dõi quá trình ủ và mở rộng DNA qua trung gian POLQ đã được phát triển với sự hợp tác của Giáo sư Kim Hajin và Ông Kim Chanwoo tại UNIST. Bà Ra Jae Sun tại IBS-CGI đã phân tích các đứt gãy nhiễm sắc thể do bức xạ LET cao gây ra. Giáo sư Fujimori Akira và ông Hirakawa Hirokazu tại QST và Giáo sư Kato Takamitsu tại Đại học bang Colorado đã thực hiện các thí nghiệm với HIMAC.
Từ khóa: bức xạ; xạ trị; ion carbon; DNA; tế bào ung thư;
– CMD&DND –