Liệu pháp xạ trị ung thư gây tổn thương DNA trong tế bào khối u bằng bức xạ ion hóa, bao gồm cả tác động trực tiếp và gián tiếp thông qua điện phân nước tạo ra các electron năng lượng thấp thứ cấp (LEE, <20 eV) và các oxy phản ứng (ROS). Các yếu tố này gây đứt gãy chuỗi hoặc liên kết chéo DNA, dẫn đến đột biến và chết tế bào ung thư. Hóa trị-xạ trị đồng thời sử dụng các tác nhân nhạy cảm với bức xạ như dẫn xuất bạch kim và nucleoside halogen hóa để tăng hiệu quả phá hủy DNA. Ngoài ra, các cấu trúc DNA thứ cấp như G-quadruplexes trong telomere có vai trò bảo vệ DNA khỏi tổn thương và trở thành mục tiêu điều trị mới. Việc hiểu cơ chế tổn thương DNA do bức xạ vẫn gặp nhiều thách thức do tính đa ngành và đa thang độ của hiện tượng, cùng với ảnh hưởng của đặc điểm nội tại như cấu trúc và trình tự DNA.
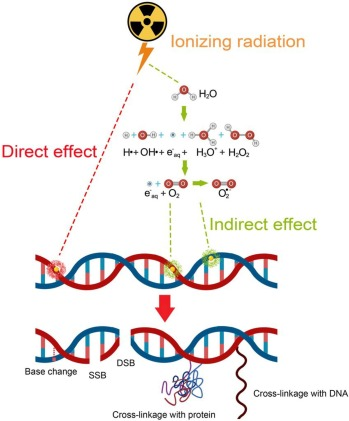
Ung thư là một trong bệnh nan giải nhất hiện nay. Để tiêu diệt các tế bào khối u ác tính, liệu pháp xạ trị ung thư sử dụng các loại bức xạ ion hóa khác nhau, khai thác khả năng gây tổn thương nghiêm trọng đến DNA trong tế bào khối u. Khi bức xạ tương tác với nước, quá trình phân hủy phóng xạ của nước xảy ra, tạo ra các hạt thứ cấp như các oxy phản ứng (ROS) và electron năng lượng thấp (LEE). Do khoảng 80% thành phần tế bào là nước, phản ứng ban đầu này quan trọng nhất trong việc tạo ra ROS và LEE, dù cũng có thể được tạo ra trực tiếp từ sự ion hóa các phân tử sinh học như DNA. LEE có năng lượng dưới 20 eV có thể gây tổn thương đáng kể cho DNA. Thông qua quá trình gắn kết electron phân ly (DEA), chúng có thể gây đứt gãy chuỗi DNA và tạo liên kết chéo giữa các chuỗi, khởi phát một chuỗi các sự kiện cản trở quá trình sao chép DNA và tiêu diệt của tế bào ung thư.
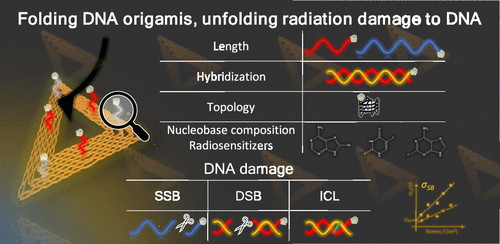
Để tăng hiệu quả điều trị, hóa trị-xạ trị đồng thời mang tiềm năng ứng dụng đầy hứa hẹn. Phương pháp này sử dụng đồng thời bức xạ và các tác nhân nhạy cảm với bức xạ, thường nhắm đến DNA, như các dẫn xuất bạch kim và nucleoside halogen hóa. Sự kết hợp này giúp tăng mức độ tổn thương DNA do bức xạ ion hóa gây ra, từ đó tăng hiệu quả kiểm soát tại chỗ khối u. Tuy nhiên, các cơ chế cụ thể mà bức xạ ion hóa gây tổn thương DNA vẫn còn phức tạp và chưa được hiểu rõ hoàn toàn. Việc làm rõ các cơ chế này đòi hỏi một cách tiếp cận liên ngành, bao phủ nhiều cấp độ từ các thành phần cơ bản của sự sống đến tế bào và sinh vật, đồng thời xem xét các hiệu ứng không gian – thời gian đa thang độ của phơi nhiễm bức xạ. Thêm vào đó, các đặc điểm nội tại của DNA như thành phần base, cấu trúc không gian, trạng thái lai hóa và hình thái topo cũng ảnh hưởng đáng kể đến phản ứng của DNA trước bức xạ ion hóa.
Các nhà khoa học đã tập trung vào việc đo lường chính xác tổn thương gây ra cho các trình tự DNA cụ thể bởi LEE và photon. Kết quả nghiên cứu thu được thông qua phương pháp thực nghiệm mới, sử dụng các cấu trúc DNA origami được thiết kế chiến lược dựa trên hình tam giác Rothemund, kết hợp với phân tích bằng kính hiển vi lực nguyên tử (AFM). Nghiên cứu cho thấy các yếu tố như thành phần nucleobase sự tích hợp các nucleobase halogen hóa, topo DNA, trạng thái lai hóa và chiều dài đều ảnh hưởng đến mức độ đứt gãy chuỗi DNA do bức xạ gây ra.
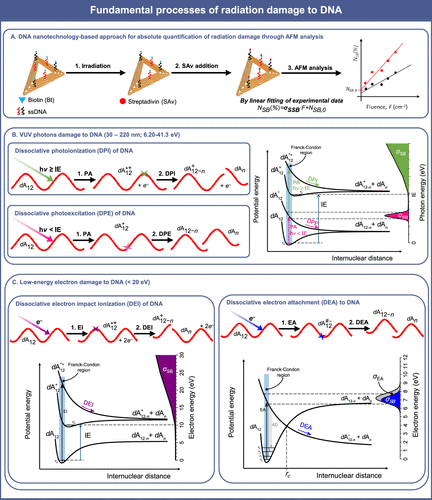
Các nhà khoa học đã phát triển một phương pháp thực nghiệm cho phép xác định chính xác tiết diện tuyệt đối của các tổn thương DNA do electron năng lượng thấp (LEE) gây ra, bao gồm đứt gãy đơn và đứt gãy kép, bằng cách sử dụng các cấu trúc DNA origami. Phương pháp này sử dụng tam giác Rothemund làm nền tảng, trên đó gắn các chuỗi oligonucleotide có gắn biotin, sau đó được chiếu xạ. Kỹ thuật DNA origami – gấp một sợi DNA dài nhờ các sợi ngắn định vị – cho phép thiết kế cấu trúc nano chính xác, rất phù hợp để định lượng tuyệt đối mức độ đứt gãy DNA, với độ nhạy cao và khả năng so sánh trực tiếp các trình tự DNA khác nhau trong cùng một thí nghiệm. Sau khi chiếu xạ, mẫu được rửa và ủ với streptavidin (SAv), vốn gắn đặc hiệu với biotin. Với kích thước 4,5 × 4,5 × 5 nm³, các phân tử SAv gắn lên DNA còn nguyên sẽ hiện rõ dưới kính hiển vi lực nguyên tử (AFM). Mỗi điểm sáng SAv tương ứng với một chuỗi DNA nguyên vẹn; điểm sáng bị mất cho thấy đã xảy ra đứt gãy.
Trong liệu pháp hóa – xạ trị, các chất nhạy cảm phổ biến nhất là các nucleoside halogen hóa như 5-fluorouracil (5FU) và gemcitabine (Gem), cũng như các dẫn xuất bạch kim như cisplatin. Các chất này làm tăng tổn thương DNA bằng cách kết hợp cơ chế lý – hóa như phản ứng với LEE, với cơ chế sinh học như chèn vào DNA và gây cản trở sao chép hoặc gây chết tế bào (apoptosis). Phản ứng của 5FU, Gem và cisplatin với LEE đã được chứng minh rõ trong pha khí, dù vẫn có khác biệt so với điều kiện sinh học. Vì vậy, việc hiểu rõ cơ chế mà các nucleoside halogen hóa gây tăng đứt gãy DNA do LEE là rất quan trọng. Các chất nhạy cảm với LEE như 5FU tham gia vào các phản ứng điện tử, trong đó có gắn kết phân ly (DEA), giúp khuếch đại tổn thương DNA và tăng hiệu quả xạ trị. Thông tin này có thể hỗ trợ thiết kế các chất nhạy cảm mới, đặc hiệu với LEE, nâng cao hiệu quả điều trị và cải thiện chất lượng sống cho bệnh nhân. Ngoài ra, còn nhiều nhóm chất nhạy cảm khác cũng hoạt hóa bởi LEE như các phân tử có ái lực electron cao (ví dụ: nimorazole, tirapazamine) và các chất tương tự base pyrimidine hay purine.
Kết quả thực nghiệm tiêu biểu:
- 2-fluoroadenine (2FA): Khi gắn 2FA – thành phần của fludarabine vào trình tự DNA 5′-d(TT(2FAT2FA)₃TT), chiếu với electron 5.5, 10 và 15 eV, cho thấy tiết diện đứt gãy chuỗi cao hơn đáng kể so với DNA không biến đổi. Ở 5.5 eV, tiết diện tăng trung bình 1,6–1,7 lần so với trình tự không có 2FA.
- 8-bromoadenine (8BrA): Khi thay thế adenine bằng 8BrA trong chuỗi 5′-d(TT(8BrATA)₃TT), chiếu xạ với electron 0.5–9 eV, kết quả cho thấy tại khoảng 7 eV, tiết diện đứt gãy DNA tăng rõ rệt so với chuỗi không biến đổi, với hệ số tăng trung bình (1,9 ± 0,6).
- 5-bromo-2′-deoxyuridine (5BrU): Với các chuỗi 5′-d(TT(XYX)₃TT) (X = A, C, G; Y = T hoặc 5BrU), khi chiếu electron 18 eV, cho thấy tiết diện phụ thuộc mạnh vào thành phần base hơn là sự có mặt của 5BrU. Hệ số tăng dao động từ 1,14 đến 1,66 tùy vào trình tự cụ thể.
- 5-fluorouracil (5FU): Khi gắn vào chuỗi 5′-d(TT(XTX)₃TT) (X = A, 5FU) và chiếu xạ với electron 10 eV, tiết diện đứt gãy tăng trung bình (1,6 ± 0,5) lần so với chuỗi không chứa 5FU.
Chuỗi nghiên cứu trên đã làm sáng tỏ cơ chế hóa – lý của quá trình nhạy cảm bức xạ, đặc biệt là qua tương tác giữa electron năng lượng thấp và DNA. Phân tích bằng kỹ thuật DNA origami kết hợp kính hiển vi AFM giúp định lượng chính xác tổn thương DNA, từ đó định hướng thiết kế các chất nhạy cảm mới trong điều trị ung thư.
Từ khóa: bức xạ; tổn thương DNA
– CMD –