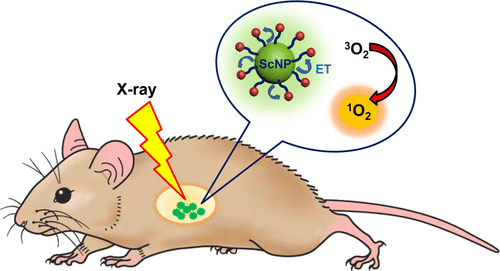
Các nhà khoa học mới đây đã phát triển một vật liệu nano đa thành phần với mục đích làm mẫu tác nhân trị liệu quang động học phóng xạ (RPDT). Vật liệu nano này được tạo ra bằng cách neo các sắc tố liên hợp trên bề mặt của các ống nano chrysotile nhấp nháy. Thành phần trong đó có thể làm cho hệ thống thiết bị trị liệu trở thành chất nhạy sáng được kích hoạt bằng cơ chế nhấp nháy để sản xuất các oxy đơn. Vật liệu nano này có khả năng tăng cường sản xuất oxy đơn trong môi trường nước thông qua chiếu xạ tia X. Hiệu quả như một chất phụ trợ cho xạ trị, tăng cường cả độc tính tế bào tức thời của bức xạ ion hóa và độc tính tế bào lâu dài do apoptosis kích hoạt bằng bức xạ. Đáng chú ý, tác nhân RPDT ở mức liều thấp được cung cấp tương đương với liều sử dụng trong các phương pháp điều trị lâm sàng. Điều này mở ra khả năng giảm tiếp xúc hiệu quả với liệu pháp xạ trị và làm giảm các tác dụng phụ không mong muốn cho bệnh nhân tiếp xúc lâu dài với bức xạ năng lượng cao.
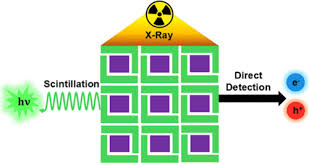
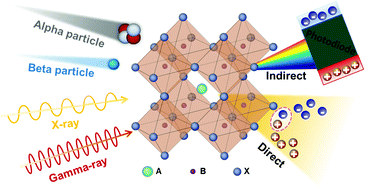
Trong những năm gần đây, công nghệ nano đã khẳng định vai trò quan trọng trong khoa học y sinh, đặc biệt là thông qua việc phát triển và ứng dụng các hạt nano trong liệu pháp xạ trị tích hợp chẩn đoán (theranostics). Nhờ đó, việc nghiên cứu quá trình sinh học trở nên sâu sắc hơn, chẩn đoán bệnh nhanh hơn, theo dõi tổn thương mô chính xác hơn, và cải thiện hiệu quả một số phương pháp điều trị truyền thống. Với các ưu điểm vượt trội như tỉ lệ diện tích bề mặt trên thể tích cao, khả năng biến đổi bề mặt linh hoạt và tính chất quang – từ cấu trúc điều chỉnh, vật liệu nano là phương tiện lý tưởng để vận chuyển thuốc hóa trị, tác nhân xạ trị và chất tăng nhạy phóng xạ xuyên qua nhiều hàng rào sinh lý. Nhờ đó, nhiều loại vật liệu nano như hạt kim loại, bán dẫn, oxit kim loại/lanthanide, vật liệu hữu cơ hoặc lai, được ứng dụng hiệu quả trong chẩn đoán – hình ảnh tiên tiến và điều trị ung thư hoặc bệnh hiểm nghèo, thể hiện qua số lượng ngày càng tăng các hệ nano được FDA phê duyệt. Đặc biệt, y học đang hướng đến việc sử dụng hạt nano phát quang dưới bức xạ (nanoscintillators) – có khả năng hấp thụ và chuyển đổi tia X hoặc γ thành photon tử ngoại/ánh sáng khả kiến. Những photon này có thể tăng hiệu quả chẩn đoán trong y học hạt nhân, định vị mô trước mổ, đo liều phóng xạ và hỗ trợ điều trị ung thư.
Tuy nhiên, các phương pháp điều trị ung thư hiện nay như hóa trị, xạ trị và phẫu thuật vẫn gặp hạn chế: tác dụng phụ toàn thân, tái phát và kháng trị. Trong đó, xạ trị được dùng trong khoảng 50% ca điều trị ung thư nhằm phá hủy DNA tế bào ác tính qua tác động trực tiếp hoặc gián tiếp thông qua các gốc tự do (ROS). Tuy nhiên, liều xạ tối đa bị giới hạn do nguy cơ gây tổn thương mô lành xung quanh. Để tăng hiệu quả và giảm liều xạ cần thiết, các hạt nano có nguyên tử số cao và mật độ lớn đang được nghiên cứu như tác nhân hỗ trợ an toàn và hiệu quả. Nhờ khả năng tương tác mạnh hơn với bức xạ năng lượng cao, chúng tạo ra nhiều hạt thứ cấp tự do gây tổn thương cục bộ mà không làm ảnh hưởng mô lành.
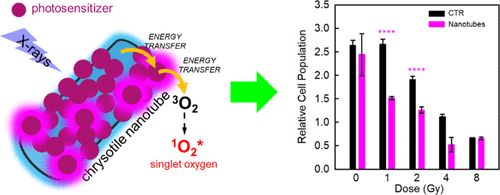
Một hướng đi mới là kết hợp xạ trị với liệu pháp quang động (PDT). PDT là phương pháp không xâm lấn, hiệu quả, có độ chọn lọc không gian cao và không bị giới hạn liều như xạ trị hoặc hóa trị. Cơ chế của PDT dựa vào các chất nhạy sáng (photosensitizer, PS) tạo ROS khi được kích hoạt bằng ánh sáng, từ đó tiêu diệt tế bào ung thư qua tổn thương màng tế bào. Tuy nhiên, các PS hiện hành cần UV/vis để hoạt hóa – dải quang phổ mà mô người hấp thụ mạnh – khiến PDT kém hiệu quả với khối u nằm sâu (trên 1 cm). Do đó, việc kết hợp PDT với xạ trị tận dụng khả năng xuyên sâu của bức xạ ion hóa sẽ giúp khắc phục cùng lúc nhược điểm về độ sâu của PDT và giới hạn liều của xạ trị, mở ra hướng điều trị ung thư hiệu quả và chọn lọc hơn.
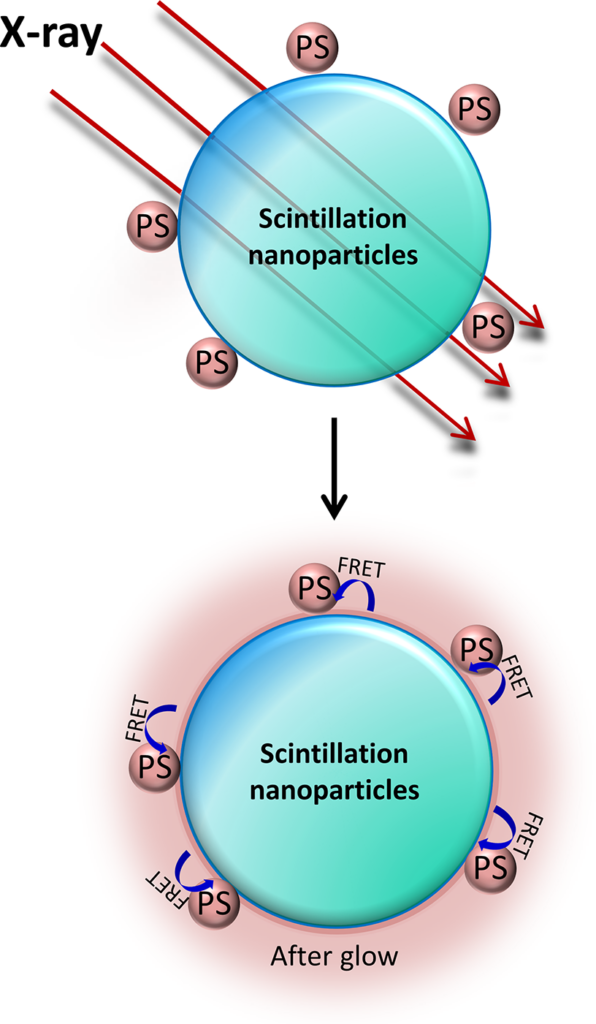
Nhìn chung, phương pháp này dựa trên việc kết hợp cấu trúc giữa hạt nano phát quang dưới bức xạ (nanoscintillator) và chất nhạy sáng (photosensitizer – PS) có mức năng lượng phù hợp với phổ phát xạ của nanoscintillator. Khi nanoscintillator hấp thụ bức xạ ion hóa, thay vì phát quang, năng lượng được chuyển đến PS thông qua quá trình truyền năng lượng, kích hoạt quá trình tạo các loại oxy phản ứng (ROS) ngay trong mô. Nhờ đó, liệu pháp kết hợp đồng thời và đồng vị trí giữa xạ trị và quang động – gọi là liệu pháp radio-quang động (RPDT) được hình thành. Trong khuôn khổ nghiên cứu, nhiều vật liệu nano vô cơ như oxit, florua, cấu trúc nền silica, tinh thể bán dẫn đã được kết hợp với PS hữu cơ để ứng dụng trong RPDT. Ngoài ra, các khung kim loại–hữu cơ (MOF) chứa nguyên tố nặng và PS cũng được đề xuất làm tác nhân RPDT. Nhiều nghiên cứu đã chứng minh hiệu quả cộng hưởng rõ rệt khi kết hợp đồng thời RT và PDT, tiếp tục khẳng định tiềm năng của phương pháp này.
Tuy nhiên, cơ chế chính xác của RPDT vẫn cần được nghiên cứu và phát triển thêm. Các giả thuyết tập trung vào việc tăng khả năng tương tác với bức xạ nhờ nguyên tố nặng, giải phóng năng lượng hiệu quả trong môi trường sinh học và tác động quang độc của PS. Dù có nhiều bằng chứng thực nghiệm, vẫn chưa có kết luận thống nhất rằng hiệu quả điều trị chủ yếu đến từ khả năng tích tụ năng lượng trong khối u, từ hiệu ứng cộng hưởng giữa RT và PDT, hay từ việc giảm tổng liều xạ cần thiết.
Các nhà khoa học đã phát triển một hệ vật liệu RPDT đa thành phần bằng cách liên hợp các ống nano chrysotile nhấp nháy với các chromophore liên kết bề mặt đóng vai trò là PS tạo oxy đơn. Khi chiếu xạ, năng lượng từ ống nano truyền cộng hưởng sang PS, sau đó kích hoạt oxy ở trạng thái cơ bản để tạo thành oxy đơn trong môi trường nước. Khả năng tạo oxy đơn và độc tính tế bào của từng thành phần được định lượng để làm cơ sở thiết kế hệ RPDT hiệu quả nhất. Kết quả cho thấy hệ nano tối ưu có khả năng tăng đáng kể lượng oxy đơn sinh ra thông qua chiếu xạ tia X, gần gấp 10 lần so với PS đơn lẻ. Khi thử nghiệm in vitro trên dòng tế bào ung thư não người U-87, hệ này giúp tăng gần một bậc độ lớn hiệu quả gây độc tế bào tức thời ở liều xạ thấp, mức thường dùng trong điều trị lâm sang, gây suy giảm lâu dài khả năng phân chia của tế bào ung thư.
Trong thành phần tối ưu, các ống nano (NTs) chức năng hóa cho thấy khả năng tạo oxy đơn cao hơn rõ rệt so với NTs nguyên bản, đặc biệt ở liều xạ thấp. Nhờ tính tương thích sinh học cao, các NTs chức năng hóa được thử nghiệm trên mô hình tế bào ung thư người và cho thấy khả năng tăng cường hiệu quả điều trị khi có mặt bức xạ ion hóa. Các thử nghiệm in vitro chỉ ra rằng: (i) NTs giúp tiêu diệt nhanh tế bào ung thư thông qua tăng hiệu ứng sốc nhiệt và (ii) hạn chế sự nhân lên của tế bào nhờ kích hoạt quá trình tự chết (apoptosis). Với ưu điểm linh hoạt trong quy trình tổng hợp, tính tương thích sinh học tốt và khả năng xuyên qua hàng rào máu não đã được chứng minh ở mô hình chuột mắc ung thư não, các kết quả này mở ra triển vọng thử nghiệm in vivo trong điều trị u não. Đáng chú ý, hiệu quả của hệ RPDT đặc biệt rõ rệt ở liều xạ thấp cho thấy tiềm năng rút ngắn thời gian điều trị, giảm tác dụng phụ do phơi nhiễm kéo dài với bức xạ, mang lại lợi ích rõ rệt về mặt y tế và kinh tế – xã hội.
Từ khóa: xạ trị;
– CMD –