Bức xạ ion hóa làm tổn thương oxy hóa trong tế bào sống. NADPH cung cấp khả năng khử không thể thiếu để tái tạo glutathione đã khử nhằm duy trì trạng thái cân bằng oxy hóa khử của tế bào. Trong tế bào động vật có vú, con đường pentose phosphate (PPP) là con đường chính để sản xuất NADPH bằng cách sử dụng các chất trung gian glycolytic và bước giới hạn tốc độ của PPP được kiểm soát bởi glucose-6-phosphate dehydrogenase (G6PD). Tuy nhiên, liệu G6PD có được sử dụng kịp thời dưới bức xạ ion hóa để đối phó với stress oxy hóa hay không vẫn còn khó nắm bắt. Ở đây các nhà khoa học chỉ ra rằng hoạt động G6PD của tế bào được tạo ra 30 phút sau khi chiếu bức xạ ion hóa, trong khi biểu hiện protein hầu như không thay đổi. Về mặt cơ học, casein kinase 2 (CK2) phosphoryl hóa G6PD T145 dưới bức xạ ion hóa, giúp củng cố hoạt tính enzyme của G6PD bằng cách tạo điều kiện cho G6PD liên kết với cơ chất NADP+ của nó. Hơn nữa, quá trình phosphoryl hóa G6PD T145 phụ thuộc vào CK2 thúc đẩy sản xuất NADPH, giảm mức ROS và hỗ trợ tăng sinh tế bào dưới bức xạ ion hóa. Các phát hiện của các nhà khoa học đã đưa ra một lộ trình truyền tín hiệu chống oxy hóa mới dưới bức xạ ion hóa, qua đó kích hoạt nhanh G6PD qua trung gian CK2 điều phối quá trình tổng hợp NADPH để duy trì cân bằng nội môi oxy hóa khử, từ đó làm nổi bật giá trị tiềm năng của nó trong điều trị sớm các tổn thương do bức xạ ion hóa.
Bức xạ ion hóa mang năng lượng đủ mạnh để ion hóa các electron từ nguyên tử, do đó dẫn đến việc tạo ra các ion. Việc tế bào sống tiếp xúc với bức xạ ion hóa có thể phá vỡ liên kết hóa học của các đại phân tử sinh học, dẫn đến những thay đổi mạnh mẽ về hóa học và sinh học. Đặc biệt, quá trình phân giải phóng xạ của nước trong tế bào tạo ra gốc hydroxyl, sau đó là superoxide và hydro peroxide là các sản phẩm tiếp theo của các loại oxy phản ứng (ROS). Quá trình sản xuất ROS được kích thích bằng quá trình phân giải phóng xạ nước xảy ra trong một khoảng thời gian cực ngắn, do đó gây ra stress oxy hóa nhanh chóng làm tổn hại đến nhiều thành phần tế bào. Nicotinamide adenine dinucleotide phosphate hydrogen (NADPH) hoạt động như một chất cho điện tử thiết yếu trong các phản ứng sinh hóa khử đa dạng, bao gồm sinh tổng hợp protein, axit nucleic và lipid. Đáng chú ý, NADPH cung cấp khả năng khử không thể thiếu trong phản ứng tái tạo glutathione khử (GSH), được xúc tác bởi glutathione reductase, để điều chỉnh trạng thái cân bằng oxy hóa khử của tế bào. GSH là phân tử chống oxy hóa chính để loại bỏ ROS tế bào trong tế bào động vật có vú. Hai phân tử GSH cung cấp hai electron để khử hydrogen peroxide thành nước và GSH theo đó được chuyển đổi thành GSSG, chất này có thể được tái chế trở lại GSH thông qua việc nhận electron từ NADPH. Do đó, sự thất bại trong quá trình tái tạo GSH do thiếu NADPH khiến tế bào dễ bị tổn thương do oxy hóa.
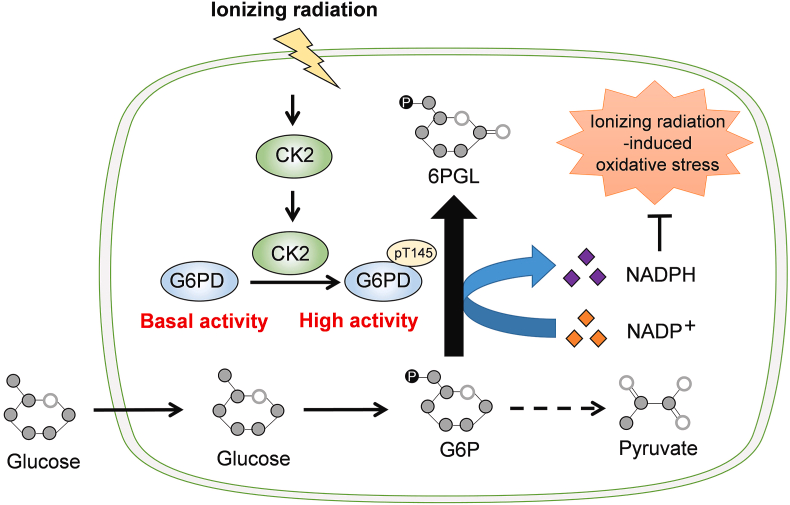
Sơ đồ kích hoạt G6PD qua trung gian CK2 dưới bức xạ ion hóa. Bức xạ ion hóa nhanh chóng tạo ra liên kết G6PD với CK2, dẫn đến sự phosphoryl hóa G6PD T145 phụ thuộc CK2, làm tăng hoạt tính enzyme G6PD và tăng cường sản xuất NADPH, từ đó tạo điều kiện cho sự tăng sinh tế bào bằng cách duy trì cân bằng nội môi oxy hóa khử tế bào. 6PGL, 6-phosphogluconolacton (Nguồn: NCBI)
Con đường pentose phosphate (PPP) là quá trình trao đổi chất cơ bản sử dụng glucose để tạo ra NADPH và 5-phosphate-ribulose, sau đó được sử dụng để tổng hợp các phân tử chứa pentose. Sau khi glucose được hexokinase chuyển thành glucose-6-phosphate (G6P), một phần của G6P nội bào sẽ tách khỏi con đường glycolytic hướng tới chu trình axit tricarboxylic và chuyển sang PPP. Glucose-6-phosphate dehydrogenase (G6PD) là enzyme giới hạn tốc độ xúc tác bước đầu tiên của PPP, chuyển G6P thành 6-phosphogluconolactone, một phản ứng không thuận nghịch quyết định lượng G6P đi vào PPP. Đáng chú ý, thông qua phản ứng này, G6P bị oxy hóa bởi G6PD làm mất electron và chuyển sang NADP+ để tạo ra NADPH. 6-phosphogluconolactone được xử lý thêm bằng 6-phosphogluconolactonase và 6-phosphogluconate dehydrogenase để tạo thành sản phẩm cuối cùng 5-phosphate-ribulose (R5P), là khối xây dựng thiết yếu để tạo ra nucleotide. Tuy nhiên, là nguồn sản xuất NADPH chính trong tế bào động vật có vú, liệu G6PD có được điều hòa kịp thời dưới bức xạ ion hóa để điều chỉnh cân bằng nội môi oxy hóa khử hay không vẫn chưa được biết rõ. Trong nghiên cứu hiện tại, các nhà khoa học chỉ ra rằng casein kinase 2 (CK2) nhanh chóng phosphoryl hóa threonine (T)145 của G6PD để đáp ứng với bức xạ ion hóa, từ đó tăng cường hoạt động enzyme của G6PD thông qua việc tạo điều kiện thuận lợi cho sự tương tác giữa G6PD và cơ chất NADP+ của nó. Trong các tế bào được chiếu xạ, quá trình phosphoryl hóa G6PD T145 phụ thuộc vào CK2 là cần thiết để sản xuất NADPH và duy trì cân bằng oxy hóa khử nội môi, từ đó hỗ trợ sự tăng sinh tế bào.
Xử lý bằng bức xạ ion hóa dẫn đến các sự kiện oxy hóa lớn trong tế bào sống điều chỉnh cấu trúc nguyên tử qua sự tương tác của các đại phân tử mục tiêu với sóng điện từ hoặc các hạt hạ nguyên tử. Đặc biệt, quá trình phân hủy phóng xạ do bức xạ ion hóa của nước tế bào dẫn đến sự tạo ra cực kỳ nhanh chóng của các phân tử phản ứng khác nhau, với sự đứt gãy ban đầu của các liên kết oxy-hydro, nitơ-hydro và carbon-hydro trong vòng 10−14∼10−12 giây và sau đó thiệt hại do oxy hóa của các đại phân tử tế bào trong vòng 10−12 giây. Hoạt động khử hydro G6P của tế bào tăng lên đã được phát hiện 30 phút sau khi bức xạ ion hóa ở cả tế bào HOK và BEAS-2B. Hơn nữa, G6PD liên kết với CK2 và sự phosphoryl hóa G6PD T145 cũng có thể được phát hiện trong vòng 30 phút sau khi bức xạ ion hóa, cho thấy rằng hoạt hóa G6PD là phản ứng nhanh đối với bức xạ ion hóa. Người ta ghi nhận rằng biểu hiện G6PD có thể được điều chỉnh tăng lên sau khi tế bào tiếp xúc với nhiều kích thích gây căng thẳng oxy hóa trong hơn 12 giờ. Ngược lại, dữ liệu của chúng tôi cho thấy biểu hiện G6PD hầu như không thay đổi trong vòng 90 phút sau bức xạ ion hóa 12 Gy, cho thấy rằng hoạt động khử hydro của G6P trong tế bào được tăng cường là do sự gia tăng hoạt động của enzyme G6PD chứ không phải do biểu hiện protein của nó. Do đó, dữ liệu hiện tại báo cáo một cơ chế mới phụ thuộc vào sự biến đổi protein, qua đó các tế bào nhanh chóng đối phó với stress oxy hóa do bức xạ ion hóa bằng cách củng cố quá trình sản xuất NADPH phụ thuộc vào G6PD.
PPP là một nhánh chính của quá trình đường phân và enzyme giới hạn tốc độ của quá trình trao đổi chất này, G6PD, góp phần chiếm tỷ lệ lớn trong quá trình sản xuất NADPH của tế bào. Thiếu G6PD là một khiếm khuyết di truyền phổ biến với hơn 400 triệu người được chẩn đoán trên toàn thế giới, điều này có thể dẫn đến tích tụ ROS và gây ra nhiều bệnh như tan máu và thoái hóa thần kinh. Các tế bào có nhân thiếu G6PD dễ bị chết tế bào do stress oxy hóa hơn do thiếu GSH. Một cách nhất quán, chúng tôi chứng minh ở đây rằng sự phosphoryl hóa G6PD T145 phụ thuộc vào CK2 là cần thiết để củng cố dòng trao đổi chất của PPP và góp phần duy trì mức NADPH của tế bào trong cả tế bào HOK và BEAS-2B được chiếu xạ. Một đột biến G6PD T145A không bị phosphoryl hóa đã làm nổi bật căng thẳng oxy hóa do bức xạ ion hóa, bao gồm cả sự giảm sóng vô tuyến của NADPH/NADP+ và GSH/GSSG, cũng như tín hiệu DCFDA và 8-OHdG tăng cường, đồng thời làm suy giảm sự tăng sinh tế bào. Do đó, kết quả của chúng tôi chỉ ra rằng quá trình phosphoryl hóa qua trung gian CK2 và kích hoạt G6PD thúc đẩy quá trình bảo vệ chống oxy hóa và hỗ trợ tăng sinh tế bào dưới bức xạ ion hóa. NADPH rất quan trọng đối với các tế bào sống vì nó cung cấp khả năng khử phổ quát để cung cấp nhiên liệu cho các enzyme chống oxy hóa để tái chế glutathione bị oxy hóa. Quá trình phosphoryl hóa qua trung gian CK2 và kích hoạt G6PD giúp tăng cường tổng hợp NADPH để hỗ trợ cân bằng nội môi oxy hóa khử tế bào, làm nổi bật giá trị tiềm năng của nó trong điều trị sớm các tổn thương do bức xạ ion hóa.
Viêm niêm mạc miệng và viêm phổi do bức xạ là những biến chứng phổ biến nhất đối với bệnh nhân được xạ trị và sự phát triển của cả hai biến chứng này đi kèm với stress oxy hóa và nhiều tổn thương tạm thời hoặc không thể phục hồi ở các mô được chiếu xạ. Các con đường trao đổi chất để sản xuất nucleotide không chỉ cung cấp các khối xây dựng cho quá trình tổng hợp DNA/RNA mà còn đóng vai trò là nguồn chính tạo ra NADPH. Dữ liệu hiện tại giúp hiểu rõ hơn về cách thức chuyển hóa nucleotide có thể được điều chỉnh nhanh chóng để đáp ứng với bức xạ ion hóa bằng cách biến đổi enzyme sau dịch mã và bổ sung thêm kiến thức về cơ chế điều hòa của cân bằng nội môi oxy hóa khử tế bào.
Từ khóa: bức xạ; glucose;
– CMD –